Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Sulfur và sulfur dioxide SVIP
I. Đơn chất sulfur
1. Trạng thái tự nhiên của sulfur
Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và dạng hợp chất. Đơn chất sulfur lắng đọng thành các mỏ lớn, nằm giữa lớp đất đá sâu hàng trăm mét trong lòng đất.

Hợp chất sulfur gồm các khoáng vật sulfide, sulfate, protein,...

2. Cấu tạo, tính chất vật lí cơ bản của sulfur đơn chất
Phân tử sulfur gồm 8 nguyên tử (S8) có dạng vòng khép kín. Mỗi nguyên tử sulfur liên kết với hai nguyên tử bên cạnh bằng hai liên kết cộng hóa trị không phân cực.
Ở điều kiện thường, sulfur là chất rắn, màu vàng, không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide (CS2),... và có tnc = 113 oC, ts = 445 oC.
3. Tính chất hóa học của sulfur đơn chất
Thí nghiệm 1: Sắt tác dụng với sulfur.
Bước 1: Lấy một thìa nhỏ bột sắt và một thìa nhỏ sulfur, trộn đều, cho vào ống nghiệm. Nút miệng ống nghiệm bằng bông.
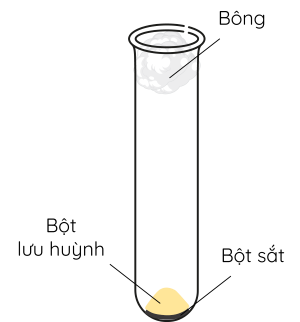
Bước 2: Đun nóng ống nghiệm trên ngọn lửa đèn cồn đến khi có đốm sáng đỏ xuất hiện thì ngừng đun.

Sulfur oxi hóa được nhiều kim loại ở nhiệt độ cao tạo thành muối sulfide.
\(Fe+S\overset{t^o}{\rightarrow}FeS\)
Sulfur tác dụng với thủy ngân (mercury) ngay ở nhiệt độ thường tạo thành muối sulfide.
\(Hg+S\rightarrow HgS\)
Thí nghiệm 2: Sulfur tác dụng với oxygen
Bước 1: Dùng thìa sắt lấy một lượng nhỏ sulfur, sau đó đốt trên ngọn lửa đèn cồn đến khi sulfur cháy.

Bước 2: Đưa nhanh thìa sắt vào bình chứa khí oxygen.
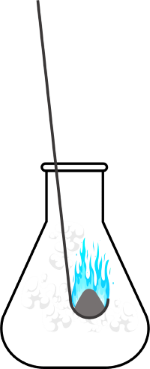
Ở nhiệt độ thích hợp, sulfur tác dụng với một số phi kim như fluorine, oxygen,...
\(S+O_2\overset{t^o}{\rightarrow}SO_2\)
4. Ứng dụng của đơn chất sulfur
Sulfur là nguyên liệu quan trọng cho nhiều ngành công nghiệp như sản xuất H2SO4, lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng, chất dẻo, dược phẩm, thuốc trừ sâu, thuốc diệt nấm,...

II. Sulfur dioxide
1. Tính chất hóa học và ứng dụng của sulfur dioxide
Sulfur dioxide là chất khí không màu, mùi xốc, độc (hít phải sẽ gây viêm đường hô hấp), nặng hơn không khí, tan nhiều trong nước.
Sulfur dioxide là chất khử có thể tác dụng với chất oxi hóa mạnh như nitrogen dioxide (NO2), halogen,...
\(SO_2+NO_2\rightarrow SO_3+NO\)
Sulfur dioxide là chất oxi hóa có thể tác dụng với chất oxi hóa mạnh như hydrogen sulfide tạo thành sulfur và nước.
\(SO_2+2H_2S\rightarrow3S+2H_2O\)
Sulfur dioxide được dùng để sản xuất sulfuric acid; chất tẩy trắng (bột giấy), khử màu (sản xuất đường); chống nấm mốc,..
2. Sự hình thành sulfur dioxide do tác động của con người, tự nhiên, tác hại của sulfur dioxide và một số biện pháp giảm thiểu lượng sulfur dioxide thải vào không khí.
Trong tự nhiên sulfur được tạo ra do khí thải núi lửa.

Trong hoạt động sản xuất, sulfur được tạo ra do quá trình đốt cháy nhiên liệu có chứa tạp chất sulfur và phương tiện giao thông.

Sulfur dioxide là một trong các tác nhân làm ô nhiễm khí quyển, gây mưa acid và viêm đường hô hấp ở người.
Để giảm thiểu lượng khí thải này, cần thực hiện một số biện pháp sau:
- Sử dụng các nguồn nhiên liệu sinh học thân thiện với môi trường như hydrogen, ethanol,... thay cho năng lượng hóa thạch.
- Khai thác các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo.
- Xử lí khí thải công nghiệp trước khi thải ra môi trường.
1. Nguyên tố sulfur tồn tại trong tự nhiên ở cả dạng đơn chất (mỏ sulfur) và dạng hợp chất (quặng sulfide, sulfate,...).
2. Đơn chất sulfur thể hiện tính oxi hóa (tác dụng với hydrogen, kim loại) và tính khử (tác dụng với oxygen, fluorine,...).
3. Sulfur dioxide vừa có tính oxi hóa vừa có tính khử. Sulfur dioxide là tác nhân gây ô nhiễm không khí, được sinh ra từ núi lửa và các hoạt động của con người.
4. Ứng dụng của sulfur: sản xuất sulfuric acid, lưu hóa cao su, sản xuất diêm, thuốc nổ, thuốc trừ sâu, diệt nấm,...
Bạn có thể đăng câu hỏi về bài học này ở đây
