Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Quy tắc octet SVIP
I. QUY TẮC OCTET
- Nhà hoá học, vật lí người Mỹ Lewis (1875 - 1946) đã đưa ra quy tắc octet để giải thích cho xu hướng các nguyên tử trở nên bền vững hơn như sau:
Trong phản ứng hoá học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững của khí hiếm.
- Các nguyên tử khí hiếm có lớp electron ngoài cùng đã bão hoà với 8 electron (trừ helium có 2 electron lớp ngoài cùng) nên rất khó tham gia vào các phản ứng hoá học.
- Các nguyên tử liên kết với nhau theo xu hướng chung là tạo ra lớp electron ngoài cùng như của khí hiếm gần nhất để mỗi nguyên tử trở nên bền vững hơn.
II. VẬN DỤNG QUY TẮC OCTET TRONG QUÁ TRÌNH HÌNH THÀNH LIÊN KẾT HOÁ HỌC CỦA CÁC NGUYÊN TỐ NHÓM A
Trong quá trình hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình bền vững như của khí hiếm gần nhất với 8 electron ở lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cùng với khí hiếm helium).
Ví dụ 1: Nhận electron
Nguyên tử chlorine có cấu hình electron là 1s22s22p63s23p5 với 7 electron lớp ngoài cùng. Cấu hình electron của nguyên tử Cl rất gần với cấu hình electron của khí hiếm Ar gần nó nhất: 1s22s22p63s23p6. Vậy để có cấu hình electron giống khí hiếm Ar thì nguyên tử Cl sẽ có xu hướng nhận thêm 1 electron, từ đó hình thành nên ion Cl- mang điện tích âm:

Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng nhận thêm electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
Ví dụ 2: Nhường electron
Nguyên tử sodium có cấu hình electron 1s22s22p63s1 có 1 electron ở lớp ngoài cùng. Cấu hình electron của nguyên tử Na rất gần với cấu hình của khí hiếm Neon gần nó nhất: 1s22s22p6. Vậy để có cấu hình electron giống khí hiếm Ne thì nguyên tử Na sẽ có xu hướng nhường đi 1 electron, từ đó hình thành nên ion Na+ mang điện tích dương:

Các kim loại với 1, 2 hoặc 3 electron lớp ngoài cùng có xu hướng nhường đi electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
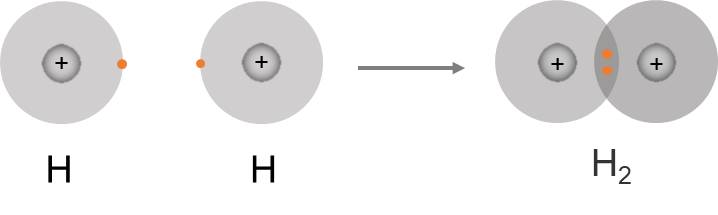
Ví dụ 3: Góp chung electron
Phân tử H2 được hình thành nhờ sự góp chung electron của hai nguyên tử H. Sau khi góp chung, mỗi nguyên tử H có 1 đôi electron dùng chung, giống với lớp vỏ bền vững của khí hiếm He.
Các em đã học:
1. Nội dung quy tắc octet: Trong quá trình hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình electron bền vững như của khí hiếm gần nhất với 8 electron ở lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cùng như của helium).
2. Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng nhận thêm electron để tạo thành ion âm tương ứng có 8 electron ở lớp ngoài cùng.
3. Các kim loại với 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường đi electron để tạo thành ion dương tương ứng với 8 electron ở lớp ngoài cùng.
Bạn có thể đăng câu hỏi về bài học này ở đây
