Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Phương trình trạng thái của khí lí tưởng SVIP
1. KHÍ LÍ TƯỞNG
Boyle và Charles đã tìm ra các định luật bằng phương pháp thực nghiệm khi tiến hành các thí nghiệm với các chất khí thực tế (khí thực) như: không khí, oxygen, nitrogen,... ở điều kiện nhiệt độ và áp suất thông thường trong phòng thí nghiệm. Nếu áp suất khí quá lớn hoặc nhiệt độ khí quá thấp thì các kết quả thực nghiệm thu được của các khí thực không còn tuân theo các định luật Boyle và Charles.
Để đơn giản trong việc nghiên cứu, người ta xây dựng khái niệm khí lí tưởng.
Khí lí tưởng là khí tuân theo đúng định luật Boyle và định luật Charles.
2. PHƯƠNG TRÌNH TRẠNG THÁI CỦA KHÍ LÍ TƯỞNG
Phương trình trạng thái của một khối lượng khí lí tưởng xác định:
\(\dfrac{pV}{T}=nR\) hay \(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\)
Trong đó $n$ là số mol khí, \(R\approx8,31\) \(\dfrac{J}{mol.K}\) là hằng số khí lí tưởng.
3. VẬN DỤNG PHƯƠNG TRÌNH TRẠNG THÁI CỦA KHÍ LÍ TƯỞNG
➤ Quá trình biến đổi đẳng tích
Từ phương trình trạng thái của khí lí tưởng, ta rút ra được phương trình liên hệ giữa áp suất và nhiệt độ tuyệt đối khi thể tích không đổi là:
\(\dfrac{p}{T}=\) hằng số hay \(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\)
Trong quá trình biến đổi đẳng tích của một khối lượng khí xác định, áp suất tỉ lệ thuận với nhiệt độ tuyệt đối.
Đường biểu diễn sự phụ thuộc của $p$ theo $T$ khi thể tích của khối khí không đổi gọi là đường đẳng tích.
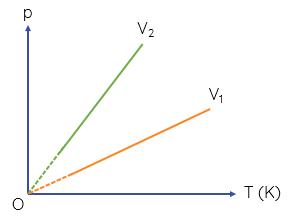
Các đường đẳng tích của một khối khí tương ứng với các thể tích \(V_1\) và \(V_2\) \(\left(V_2< V_1\right)\)
1. Khí lí tưởng là khí tuân theo đúng định luật Boyle và định luật Charles.
2. Phương trình trạng thái của một khối lượng khí lí tưởng xác định:
\(\dfrac{pV}{T}=nR\) hay \(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\)
Bạn có thể đăng câu hỏi về bài học này ở đây
