Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Phản ứng hóa học và năng lượng trong các phản ứng hóa học SVIP
1. Phản ứng hoá học
➤ Tìm hiểu về phản ứng hóa học
Quá trình biến đổi chất này thành chất khác được gọi là phản ứng hóa học.
- Chất tham gia phản ứng gọi là chất đầu.
- Chất mới tạo thành gọi là sản phẩm.
Thí nghiệm: Phản ứng giữa sắt (iron) và lưu huỳnh (sulfur)
Dụng cụ và hoá chất: bát sứ, thìa xúc hoá chất, đèn cồn, ống nghiệm chịu nhiệt, kẹp ống nghiệm, nam châm, bột lưu huỳnh (S), bột sắt (Fe).
Cách tiến hành:
Bước 1: Trộn đều một lượng lưu huỳnh và một lượng vừa đủ bột sắt (theo tỉ lệ khối lượng gồm 4 phần sắt và 7 phần lưu huỳnh) rồi chia đều vào hai ống nghiệm (1) và (2).
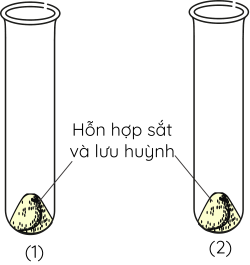
Bước 2: Hơ đều ống nghiệm (2) rồi tập trung đun nóng mạnh ở đáy ống nghiệm đến khi xuất hiện chất rắn màu đen thì ngừng đun.
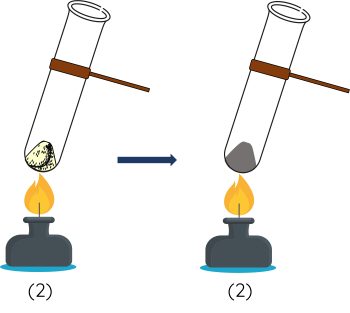
Bước 3: Để chất rắn trong ống nghiệm (2) nguội rồi cho vào bát sứ, cho hỗn hợp trong ống nghiệm (1) vào bát sứ khác, sau đó đưa nam châm lại gần chất rắn trong 2 bát sứ và quan sát.

2. Diễn biến của phản ứng hoá học
➤ Tìm hiểu quá trình biến đổi trong phản ứng hóa học
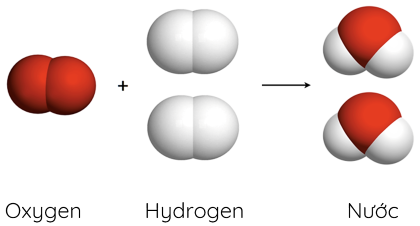
Trong phản ứng hóa học, chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác. Kết quả là chất này bị biến đổi thành chất khác.
3. Một số dấu hiệu nhận biết có phản ứng hóa học xảy ra
➤ Tìm hiểu các dấu hiệu chứng tỏ có phản ứng hóa học xảy ra

|

|

|

|
Một số dấu hiệu có thể nhận biết phản ứng hóa học xảy ra: xuất hiện chất khí, chất kết tủa; thay đổi màu sắc, mùi; phát sáng, giải phóng hoặc hấp thụ nhiệt năng;...
4. Năng lượng trong phản ứng hoá học
➤ Tìm hiểu phản ứng tỏa nhiệt, thu nhiệt
Phản ứng tỏa nhiệt là phản ứng có sự giải phóng năng lượng ra môi trường bên ngoài, thể hiện ở sự gia tăng nhiệt độ.
Ví dụ:


Những phản ứng tỏa nhiệt có thể được viết tổng quát như sau:
chất phản ứng → sản phẩm + năng lượng
Phản ứng thu nhiệt là những phản ứng hấp thụ năng lượng từ môi trường xung quanh.
Những phản ứng thu nhiệt có thể được viết tổng quát như sau:
chất phản ứng + năng lượng → sản phẩm
➤ Tìm hiểu các ứng dụng của phản ứng toả nhiệt
Sự đốt cháy nhiên liệu (than, dầu hoả, gas,…) tạo ra năng lượng nhiệt phục vụ cho việc nấu nướng, sưởi ấm,…

Quá trình hô hấp trong cơ thể cung cấp năng lượng để cơ thể hoạt động, đồng thời tạo nên thân nhiệt ổn định và hỗ trợ quá trình vận động.
1. Quá trình biến đổi chất này thành chất khác được gọi là phản ứng hoá học. Chất tham gia phản ứng gọi là chất đầu, chất mới tạo thành gọi là sản phẩm.
2. Trong phản ứng hoá học, có sự phá vỡ liên kết cũ và hình thành liên kết mới. Kết quả là chất này biến đổi thành chất khác.
3. Một số dấu hiệu có thể nhận biết phản ứng hoá học xảy ra: xuất hiện chất khí, chất kết tủa; thay đổi màu sắc, mùi; phát sáng, giải phóng hoặc hấp thụ nhiệt năng,…
4. Phản ứng toả nhiệt là phản ứng hoá học kèm theo sự giải phóng nhiệt năng ra môi trường. Phản ứng thu nhiệt là phản ứng hoá học nhận năng lượng từ môi trường xung quanh.
5. Khi đốt cháy than, xăng, dầu,… sẽ toả ra một lượng nhiệt lớn, đây chính là phản ứng toả nhiệt. Lượng nhiệt này sẽ phục vụ cho các hoạt động trong đời sống và sản xuất của con người.
Bạn có thể đăng câu hỏi về bài học này ở đây
