Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 0 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Nitrogen SVIP
I. Trạng thái tự nhiên
Nitrogen là nguyên tố phổ biến nhất trong khí quyển, chiếm 75,5% về khối lượng (78,1% về thể tích), tập trung chủ yếu ở tầng đối lưu.
Trong vỏ Trái Đất, nguyên tố nitrogen tồn tại tập trung ở một số mỏ khoáng dưới dạng sodium nitrate (NaNO3), thường gọi là diêm tiêu Chile.
Nguyên tố nitrogen có trong tất cả cơ thể động, thực vật, là thành phần cấu tạo nên nucleic acid, protein,... Trong cơ thể người, nitrogen chiếm khoảng 3% khối lượng, đứng thứ tư sau oxygen, carbon và hydrogen.
Nguyên tố nitrogen tồn tại trong tự nhiên với hai đồng vị bền là 14N (99,63%) và 15N (0,37%).
II. Cấu tạo nguyên tử, phân tử
1. Cấu tạo nguyên tử
- Nguyên tố nitrogen nằm ở ô số 7, nhóm VA, chu kì 2 trong bảng tuần hoàn.
- Nguyên tử nitrogen có độ âm điện lớn (3,04).
- Nitrogen là phi kim điển hình.
- Nitrogen tạo ra nhiều hợp chất với các số oxi hóa khác nhau từ bao gồm -3, 0, từ +1 đến +5.
2. Cấu tạo phân tử
- Phân tử nitrogen gồm hai nguyên tử, liên kết với nhau thông qua liên kết cộng hóa trị.
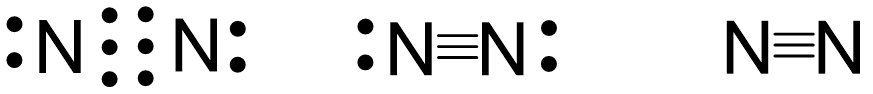
- Phân tử nitrogen có năng lượng liên kết lớn (945 kJ/mol) và không có cực.
III. Tính chất vật lí
- Ở điều kiện thường, nitrogen là chất khí, không màu, không mùi, không vị, khó hóa lỏng (hóa lỏng ở -196oC).
- Khí nitrogen tan rất ít trong nước (1 lít nước hòa tan được 0,012 lít khí nitrogen).
- Khí nitrogen không duy trì sự cháy và sự hô hấp.
IV. Tính chất hóa học
Ở điều kiện thường, nitrogen khá trơ về mặt hóa học. Ở nhiệt độ cao, nitrogen trở nên hoạt động hơn, thể hiện cả tính oxi hóa và tính khử.
1. Tác dụng với hydrogen
Ở nhiệt độ cao, áp suất cao và có xúc tác, nitrogen phản ứng với hydrogen tạo thành ammonia.
.png)
Đây là quá trình quan trọng để sản xuất ammonia (quá trình Haber – Bosch), từ đó sản xuất nitric acid, thuốc nổ, đạm nitrate, urea, ammophos,...
2. Tác dụng với oxygen
Ở nhiệt độ cao trên 3000oC hoặc có tia lửa điện, nitrogen kết hợp với oxygen, tạo ra nitrogen monoxide (NO).
.png)
Quá trình này có hiệu suất rất thấp.
Trong tự nhiên, phản ứng trên xảy ra trong những cơn mưa dông kèm sấm sét, khởi đầu cho quá trình chuyển hóa từ nitrogen thành nitric acid. Nitric acid tan trong nước mưa, phân li ra ion nitrate (NO3-), cây trồng hấp thụ để sinh trưởng, phát triển. Quá trình này được biểu diễn theo sơ đồ sau:
.png)
Trong thực tế, phản ứng hóa hợp giữa nitrogen và oxygen thường xảy ra đồng thời với quá trình đốt cháy nhiên liệu ở nhiệt độ cao bằng không khí. Các hoạt động giao thông vận tải và sản xuất công nghiệp là nguyên nhân chính gây phát thải các oxide của nitrogen vào khí quyển.

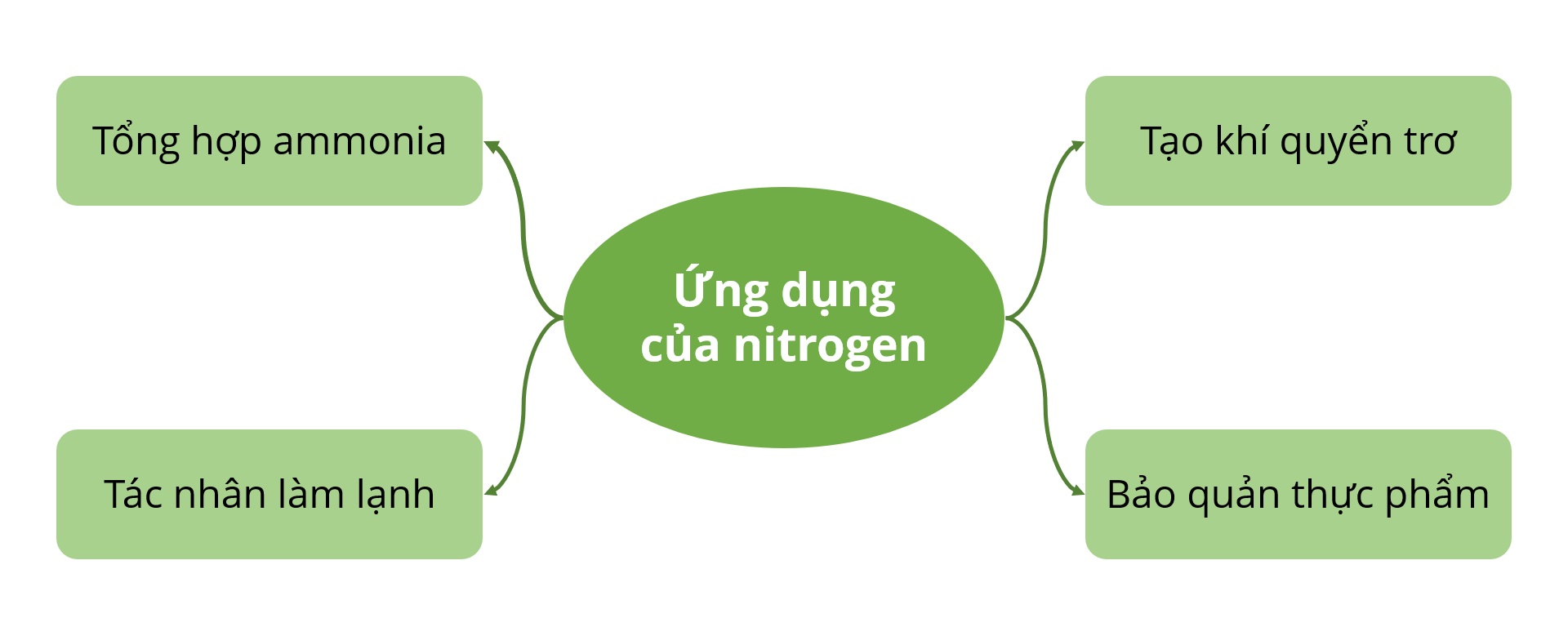
V. Ứng dụng
1. Nguyên tố nitrogen tồn tại trong tự nhiên ở cả dạng đơn chất (trong khí quyển) và dạng hợp chất (nitrate, nucleic acid, protein,...).
2. Hai nguyên tử trong phân tử nitrogen liên kết với nhau bằng một liên kết ba bền vững nên đơn chất nitrogen kém hoạt động hóa học ở điều kiện thường, hoạt động hóa học mạnh hơn ở nhiệt độ cao. Đơn chất nitrogen thể hiện cả tính oxi hóa (tác dụng với hydrogen) và tính khử (tác dụng với oxygen).
3. Nitrogen có nhiều ứng dụng trong các ngành sản xuất hóa chất, bảo quản thực phẩm, dược phẩm, mẫu vật phẩm y tế,...
Bạn có thể đăng câu hỏi về bài học này ở đây
