Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. NỘI DUNG THÍ NGHIỆM VÀ CÁCH TIẾN HÀNH
1. Điều chế khí clo. Tính tẩy màu của khí clo ẩm
- Cách tiến hành: Cho vào ống nghiệm khô một vài tinh thể KMnO4, nhỏ tiếp vào ống nghiệm vài giọt dung dịch HCl đậm đặc. Đậy ống nghiệm bằng nút cao su có dính một băng giấy màu ẩm. Quan sát hiện tượng.
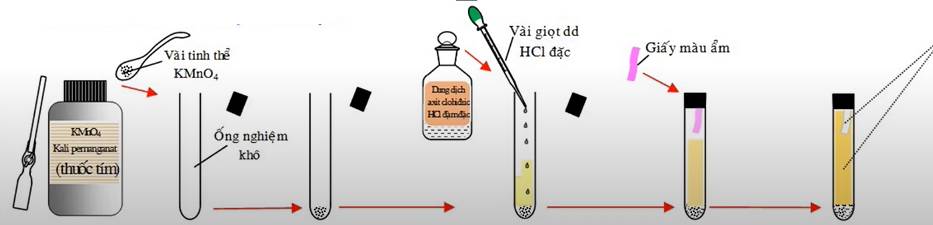
- Hiện tượng: Có khí màu vàng thoát ra. Quỳ tím ẩm dần dần bị mất màu.
- Giải thích: Khí màu vàng là do clo được tạo thành do phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Sau đó clo tan vào nước tạo ra HClO (axit có tính oxi hóa mạnh) làm mất màu quỳ tím.
Cl2 + H2O ⇌ HCl + HClO
2. Điều chế axit clohidric
- Cách tiến hành: Cho vào ống nghiệm (1) một ít muối ăn rồi rót dung dịch H2SO4 đặc. Rót khoảng 8ml nước cất vào ống nghiệm (2). Đun nhẹ ống nghiệm chứa NaCl rắn và H2SO4 đặc. Nếu thấy sủi bọt mạnh thì ngừng đun. Sau đó nhúng mẩu quỳ tím vào dung dịch trong ống (2).
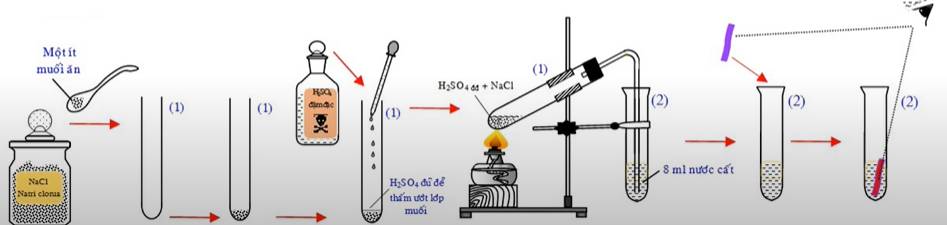
Hiện tượng: Khi đun ống nghiệm chứa NaCl rắn và H2SO4 đặc có khói trắng bay lên (khí HCl) sau đó dẫn sang ống nghiệm chứa H2O.
NaCl(rắn) + H2SO4(đặc)
NaHSO4 + HCl
Cho giấy quỳ tím vào ống nghiệm chứa H2O (đã hấp thụ khí HCl) giấy quỳ chuyển sang màu đỏ do HCl tan trong nước tạo thành dung dịch axit mạnh.
3. Bài tập thực nghiệm phân biệt các dung dịch
- Phân biệt 3 dung dịch HCl, NaCl, HNO3.
Cách 1:
Dùng quỳ tím phân biệt được NaCl vì không có hiện tượng.
Dùng tiếp dung dịch AgNO3 phân biệt được HCl vì có kết tủa trắng.
PTHH: AgNO3 + HCl → AgCl↓ + HNO3
Còn lại là HNO3.
Cách 2:
Dùng AgNO3 phân biệt được HNO3 vì không có hiện tượng. Hai dung dịch còn lại thấy có kết tủa trắng.
AgNO3 + HCl → AgCl↓ + HNO3
AgNO3 + NaCl → AgCl↓ + NaNO3
Dùng tiếp quỳ tím phân biệt được NaCl vì không có hiện tượng.
II. TƯỜNG TRÌNH
| Thí nghiệm | Cách tiến hành | Hiện tượng | Giải thích, PTHH |
Điều chế khí clo. Tính tẩy màu của khí clo ẩm | Cho vào ống nghiệm khô một vài tinh thể KMnO4, nhỏ tiếp vào ống nghiệm vài giọt dung dịch HCl đậm đặc. Đậy ống nghiệm bằng nút cao su có dính một băng giấy màu ẩm. | Có khí màu vàng thoát ra. Quỳ tím ẩm dần dần bị mất màu. | Khí màu vàng là do clo được tạo thành do phản ứng: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O Sau đó clo tan vào nước tạo ra HClO (axit có tính oxi hóa mạnh) làm mất màu quỳ tím. Cl2 + H2O ⇌ HCl + HClO |
Điều chế axit clohidric | Cho vào ống nghiệm (1) một ít muối ăn rồi rót dung dịch H2SO4 đặc. Rót khoảng 8ml nước cất vào ống nghiệm (2). Đun nhẹ ống nghiệm chứa NaCl rắn và H2SO4 đặc. Sau đó nhúng mẩu quỳ tím vào dung dịch trong ống (2). | Khi đun ống nghiệm chứa NaCl rắn và H2SO4 đặc có khói trắng bay lên (khí HCl) . Cho giấy quỳ tím vào ống nghiệm chứa H2O (đã hấp thụ khí HCl) giấy quỳ chuyển sang màu đỏ. | Do có phản ứng giữa NaCl và H2SO4 đặc sinh ra muối NaHSO4 và khí HCl. NaCl(rắn) + H2SO4(đặc) Giấy quỳ tím chuyển sang màu đỏ vì HCl tan trong nước tạo thành dung dịch axit mạnh. |
Phân biệt 3 dung dịch HCl, NaCl, HNO3.
| Dùng quỳ tím để nhận biết dung dịch NaCl, sau đó dùng dung dịch AgNO3 để phân biệt HCl và HNO3. | Cho quỳ tím vào 3 dung dịch thì dung dịch NaCl không làm đổi màu quỳ tím. Dung dịch AgNO3 có tạo kết tủa trắng khi cho vào dung dịch HCl. | AgNO3 + HCl → AgCl↓ + HNO3 |
Dùng AgNO3 phân biệt được HNO3 vì không có hiện tượng. Dùng tiếp quỳ tím phân biệt được NaCl vì không có hiện tượng. | AgNO3 không phản ứng với HNO3, tạo kết tủa trắng khi phản ứng với HCl và NaCl. Cho quỳ tím vào 2 dung dịch NaCl và HCl thì bình đựng dung dịch HCl làm quỳ tím chuyển đỏ | AgNO3 + HCl → AgCl↓ + HNO3 AgNO3 + NaCl → AgCl↓ + NaNO3 |
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Bạn có thể đăng câu hỏi về bài học này ở đây
