Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. HÓA TRỊ
1. Hóa trị trong hợp chất ion
Trong hợp chất ion, hóa trị của một nguyên tố bằng điện tích ion và được gọi là điện hóa trị của nguyên tố đó.

Ví dụ:
- Trong hợp chất NaCl, Na có điện hóa trị là 1+ và Cl có điện hóa trị là 1-.
- Trong hợp chất CaF2, Ca có điện hóa trị là 2+ và F có điện hóa trị là 1-.
Trong các hợp chất ion, các nguyên tố kim loại nhóm IA, IIA, IIIA có số electron hóa trị ở lớp ngoài cùng lần lượt là 1, 2, 3 nên có thể mất đi 1, 2, 3 electron và có điện hóa trị 1+, 2+, 3+.
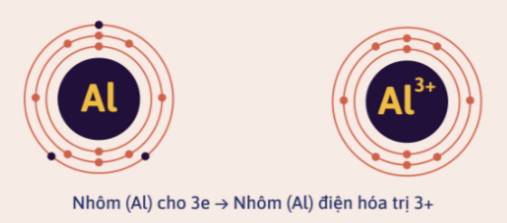
Các nguyên tố phi kim thuộc nhóm VIA, VIIA có 6, 7 electron hóa trị ở lớp ngoài cùng, nên có thể nhận thêm 2 hay 1 electron và có điện hóa trị là 2-, 1-.
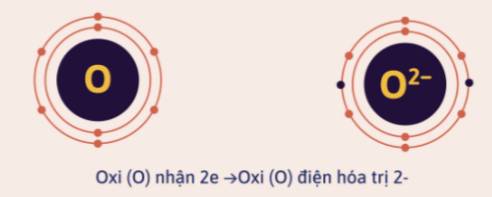
Khi viết điện hóa trị của nguyên tố, ta ghi giá trị điện tích trước, dấu của điện tích sau.
2. Hóa trị trong hợp chất cộng hóa trị
Trong hợp chất cộng hóa trị, hóa trị của một nguyên tố được xác định bằng số liên kết của nguyên tử nguyên tố đó trong phân tử và được gọi là cộng hóa trị của nguyên tố đó.
Ví dụ:
- Trong công thức cấu tạo của phân tử H2O, H-O-H, nguyên tố H có cộng hóa trị 1, nguyên tố O có cộng hóa trị 2.
- Trong công thức cấu tạo của phân tử CH4, nguyên tử C có cộng hóa trị 4, nguyên tố H có cộng hóa trị 1.
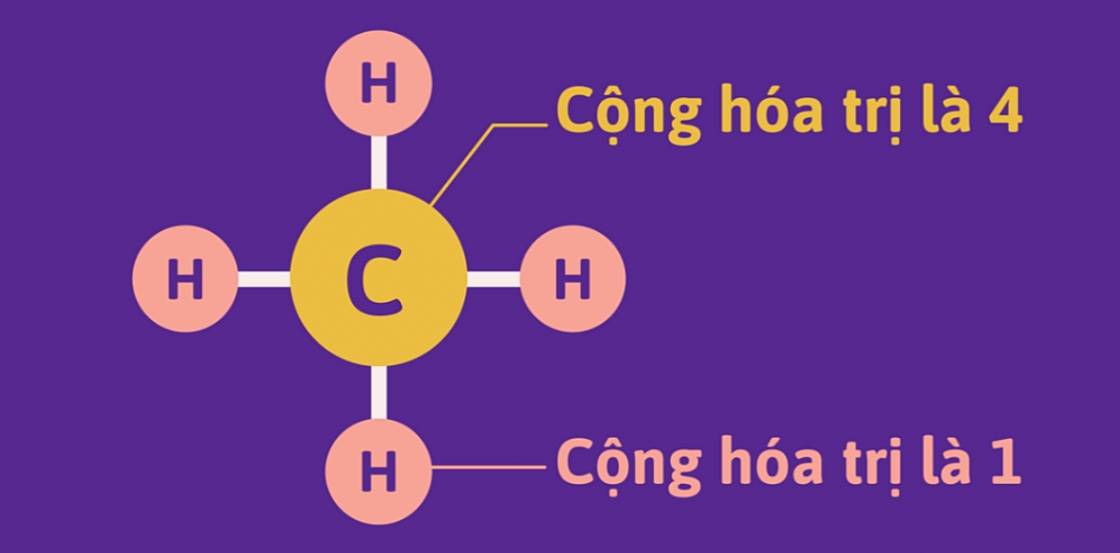
II. SỐ OXI HÓA
Số oxi hóa của một nguyên tố trong phân tử là điện tích của nguyên tử nguyên tố đó trong phân tử nếu giả định rằng mọi liên kết trong phân tử đều là liên kết ion.
Quy tắc xác định số oxi hóa của một nguyên tố
- Quy tắc 1: Trong các đơn chất, số oxi hóa của nguyên tố bằng không. Ví dụ: Trong các đơn chất như Cu, Zn, H2, N2, O2 ... số oxi hóa của các nguyên tố tương ứng đều bằng không.

- Quy tắc 2: Trong hầu hết các hợp chất, số oxi hóa của hidro bằng +1, trừ một số trường hợp như hidrua kim loại (NaH, CaH2...). Số oxi hóa của oxi bằng -2, trừ trường hợp OF2, peoxit (chẳng hạn H2O2)...
- Quy tắc 3: Trong một phân tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng không.

- Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tố bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng điện tích ion đó.

Ví dụ: Xác định số oxi hóa của S trong ion SO42-.
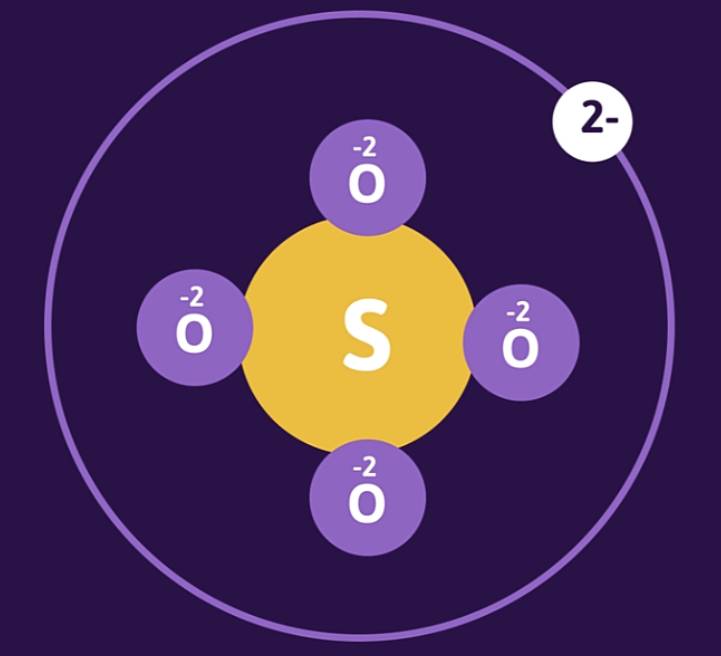
Gọi số oxi hóa của S trong ion SO42- là x. Ta có:
x + (-2).4 = -2
=> x = +6
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Bạn có thể đăng câu hỏi về bài học này ở đây
