Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
A. KIẾN THỨC CẦN LẮM
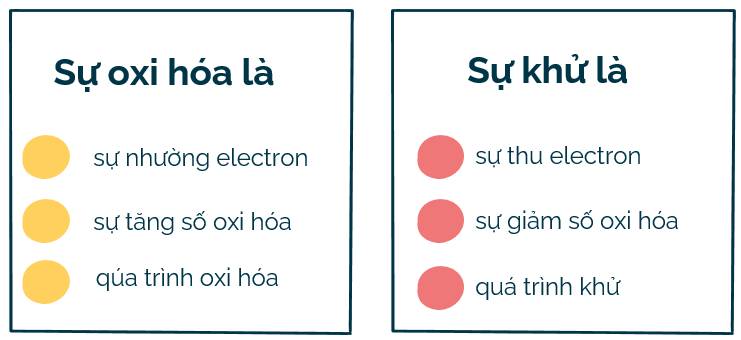
1. Sự oxi hóa là sự nhường electron, là sự tăng số oxi hóa.
Sự khử là sự thu electron, là sự giảm số oxi hóa.
Người ta gọi sự oxi hóa là quá trình oxi hóa, sự khử là quá trình khử.
2. Sự oxi hóa và sự khử là hai quá trình có bản chất ngược nhau những xảy ra đồng thời trong một phản ứng. Đó là phản ứng oxi hóa - khử.
3. Chất khử là chất nhường electron, là chất chứa nguyên tố có số oxi hóa tăng sau phản ứng.
Chất oxi hóa là chất thu electron, là chất chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Trong phản ứng oxi hóa - khử bao giờ cũng có chất khử và chất oxi hóa tham gia phản ứng. Chất khử là chất bị oxi hóa và chất oxi hóa gọi là chất bị khử.

4. Phản ứng oxi - hóa khử là phản ứng trong đó có sự chuyển electron giữa các chất trong phản ứng. Nếu dựa vào sự thay đổi số oxi hóa thì phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một nguyên tố.
5. Dựa vào số oxi hóa người ta chia các phản ứng thành hai loại, đó là phản ứng oxi hóa - khử (có số oxi hóa thay đổi) và phản ứng không thuộc loại phản ứng oxi hóa - khử (số oxi hóa không thay đổi).
B. BÀI TẬP
Bài 1. Cân bằng các phản ứng hóa học sau bằng phương pháp thăng bằng electron.
a. Al + HNO3 → Al(NO3)3 + NO2 + H2O
b. Cu + HNO3 → Cu(NO3)2 + NO + H2O
c. Fe + H2SO4 đặc → Fe2(SO4)3 + SO2 + H2O
d. Zn + HNO3 → Zn(NO3)2 + N2O + H2O
Lời giải
a.
Quá trình oxi hóa: Al0 → Al+3 + 3e (1)
Quá trình khử: N+5 + e → N+4 (2)
Áp dụng phương pháp thăng bằng electron ta nhân 3 vào (2)
Al0 → Al+3 + 3e
3 x N+5 + e → N+4
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
b.
Quá trình oxi hóa: Cu0 → Cu+2 + 2e (1)
Quá trình khử: N+5 + 3e → N+2 (2)
Để số electron nhường bằng số electron nhận, ta nhân 3 vào (1) và nhân 2 vào (2).
3 x Cu0 → Cu+2 + 2e
2 x N+5 + 3e → N+2
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
c.
Quá trình oxi hóa: Fe0 → Fe+3 + 3e (1)
Quá trình khử: S+6 + 2e → S+4 (2)
Để số electron nhường bằng số electron nhận, ta nhân 2 vào (1) và nhân 3 vào (2).
2 x Fe0 → Fe+3 + 3e
3 x S+6 + 2e → S+4
2Fe + 6H2SO4 đặc → Fe2(SO4)3 + 3SO2 + 6H2O
d.
Quá trình oxi hóa: Zn0 → Zn+2 + 2e (1)
Quá trình khử: 2N+5 + 8e → N2+1 (2)
Để số electron nhường bằng số electron nhận, ta nhân 4 vào (1).
4Zn + 10HNO3 → 4Zn(NO3)2 + N2O + 5H2O
Bài 2. Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí N2 duy nhất (đktc). Tính giá trị của V.
Lời giải
nMg = 2,4 : 24 = 0,1 mol, gọi số mol N2 là x mol.
Quá trình oxi hóa: Mg0 → Mg+2 + 2e
0,1 → 0,2
Quá trình khử: 2N+5 + 10e → N20
10x ← x
Áp dụng ĐLBT electron ta có: 10x = 0,2
=> x = 0,02 mol
Vậy thể tích khí N2 thu được bằng 0,02.22,4 = 0,448 lít.
Bài 3. Cho 2,6 gam bột kẽm vào 100 ml dung dịch CuCl2 0,75M. Lắc kĩ cho đến khi phản ứng kết thúc. Xác định số mol của các chất trong dung dịch thu được.
Lời giải
nZn = 2,6/65 = 0,04 mol
n\(CuCl_2\) = 0,75 x 0,1 = 0,075 mol
Zn + CuCl2 → ZnCl2 + Cu
n\(CuCl_2\) > nZn => Zn phản ứng hết, CuCl2 dư.
n\(CuCl_2\) phản ứng = nZn = 0,04 mol.
Trong dung dịch thu được ta có:
n\(ZnCl_2\) = 0,04 mol
n\(CuCl_2\) = 0,075 - 0,04 = 0,035 mol
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Bạn có thể đăng câu hỏi về bài học này ở đây
