Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. HẠT NHÂN NGUYÊN TỬ
1. Điện tích hạt nhân
a) Proton mang điện tích 1+, nếu hạt nhân có Z proton thì điện tích của hạt nhân bằng Z+ và số đơn vị điện tích hạt nhân bằng Z.

b) Nguyên tử trung hòa về điện nên số proton của hạt nhân (mang điện dương) bằng số electron (mang điện âm) của nguyên tử.
Số đơn vị điện tích hạt nhân Z = số proton = số electron
Ví dụ: Nguyên tử Na có số đơn vị điện tích hạt nhân là 11 thì số hạt proton = số electron = 11.
2. Số khối
a) Số khối (kí hiệu là A) là tổng số hạt proton (kí hiệu Z) và tổng số hạt nơtron (kí hiệu N) của hạt nhân đó:

Ví dụ: Hạt nhân nguyên tử liti có 3 proton và 4 nơtron, vậy số khối của hạt nhân nguyên tử liti là A = 3 + 4 = 7
b) Số đơn vị điện tích hạt nhân Z và số khối A đặc trưng cho hạt nhân và cũng đặc trưng cho nguyên tử vì khi biết Z và A của một nguyên tử sẽ biết được số proton, số electron và cả số nơtron trong nguyên tử đó (N = A - Z).
Ví dụ: Nguyên tử Al có A = 27 và Z = 13 nên nguyên tử Al có số proton = số electron = 13, số nơtron = A - Z = 27 - 13 = 14.
II. NGUYÊN TỐ HÓA HỌC
1. Định nghĩa
Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân.
Ví dụ: Tất cả các nguyên tố có cùng đơn vị điện tích hạt nhân là 11 đều thuộc nguyên tố natri. Chúng đều có 11 proton và 11 electron.
2. Số hiệu nguyên tử
Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử của nguyên tố đó, kí hiệu là Z.
3. Kí hiệu nguyên tử
Số đơn vị điện tích hạt nhân và số khối được coi là những đặc trưng cơ bản của nguyên tử. Để kí hiệu nguyên tử, người ta đặt kí hiệu các chỉ số đặc trưng ở bên trái kí hiệu nguyên tố X với số khối A ở trên và số hiệu nguyên tử Z ở dưới: \(^A_ZX\).
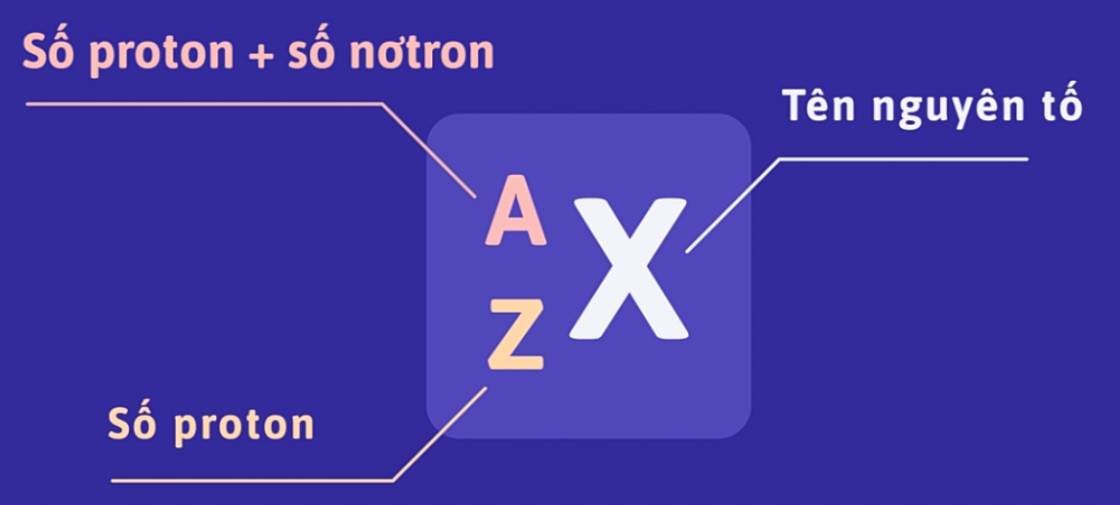
Ví dụ:

Kí hiệu trên cho ta biết:
- Số hiệu nguyên tử của nguyên tố Na là 11 nên số đơn vị điện tích hạt nhân nguyên tử là 11, vậy nguyên tử Na có 11 proton và 11 electron.
- Số khối của Na là 23 nên trong hạt nhân có 12 nơtron (23 - 11 = 12).
III. ĐỒNG VỊ
- Các nguyên tử của cùng một nguyên tố hóa học có thể có số khối khác nhau vì hạt nhân của các nguyên tử đó có số proton như nhau nhưng có thể có số nơtron khác nhau.
- Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số notron, do đó số khối A của chúng khác nhau.
- Các đồng vị được xếp vào cùng một vị trí (ô nguyên tố) trong bảng tuần hoàn.

Ví dụ. nguyên tố H có 3 đồng vị sau:
 Proti (\(^1_1H\)) | 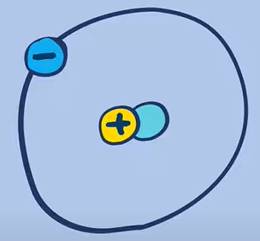 Đơteri (\(^2_1H\)) | 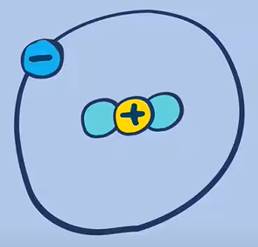 Triti (\(^3_1H\)) |
Hạt nhân chỉ gồm 1 proton (trường hợp duy nhất không có nơtron), chiếm 99,984% số nguyên tử hidro tự nhiên | Hạt nhân gồm 1 proton và 1 nơtron, chiếm 0,016% số nguyên tử hidro tự nhiên | Hạt nhân gồm 1 proton và 2 nơtron (trường hợp duy nhất có số nơtron bằng 2 lần số proton), chiếm khoảng 10-7% số nguyên tử hidro tự nhiên. |
IV. NGUYÊN TỬ KHỐI VÀ NGUYÊN TỬ KHỐI TRUNG BÌNH CỦA CÁC NGUYÊN TỐ HÓA HỌC
1. Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử.
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
- Khối lượng của một nguyên tử bằng tổng khối lượng của proton, notron và electron trong nguyên tử đó, nhưng do khối lượng của electron quá nhỏ so với hạt nhân nên có thể bỏ qua. Vì vậy, khối lượng của nguyên tử coi như bằng tổng khối lượng của các proton và nơtron trong hạt nhân nguyên tử.
- Nguyên tử khối coi như bằng số khối (khi không cần độ chính xác cao).
Ví dụ: Nguyên tử khối của P là 31 vì Z = 15 và N = 16.
2. Nguyên tử khối trung bình
Nhiều nguyên tố hóa học tồn tại nhiều đồng vị trong tự nhiên nên nguyên tử khối của nguyên tố này là nguyên tử khối trung bình của các đồng vị đó.
Công thức tính nguyên tử khối trung bình của một nguyên tố là:
\(\overline{A}=\frac{aX+bY}{100}\)
Trong đó, X và Y là nguyên tử khối của đồng vị X và đồng vị Y; a và b là phần trăm số nguyên tử của đồng vị X và Y.
Ví dụ: Clo có 2 đồng vị bền là \(^{35}_{17}Cl\) (chiếm 75,77%) và \(^{37}_{17}Cl\) (chiếm 24,23%). Nguyên tử khối trung bình của Clo là:
\(\overline{A}=\dfrac{75,77.35+24,23.37}{100}=35,5\)
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Bạn có thể đăng câu hỏi về bài học này ở đây
