Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. ĐỊNH NGHĨA
Chúng ta hãy xét một số phản ứng để hiểu được bản chất của phản ứng oxi hóa - khử.
| Phản ứng | Số oxh trước phản ứng | Số oxh sau phản ứng | Kết luận |
| 2Mg + O2 → MgO | Mg: 0 O: 0 | Mg: +2 O: -2 | Mg nhường electron và là chất khử, oxi là chất oxi hóa. \(\overset{0}{Mg}\) → \(\overset{+2}{Mg}\) + 2e Quá trình Mg nhường 2 electron là quá trình oxi hóa Mg. |
| CuO + H2 → Cu + H2O | Cu: +2 O: -2 H: 0 | Cu: 0 H: +1 | \(\overset{+2}{Cu}\) + 2e → \(\overset{0}{Cu}\) Quá trình \(\overset{+2}{Cu}\) nhận electron gọi là quá trình khử \(\overset{+2}{Cu}\). CuO là chất oxi hóa, H2 là chất khử. |
Từ hai phản ứng trên ta thấy:
- Chất khử (chất bị oxi hóa) là chất nhường electron.
- Chất oxi hóa (chất bị khử) là chất thu electron.
- Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình thu electron.

Ta xét các phản ứng không có oxi tham gia.
Ví dụ 1: Natri cháy trong khí clo tạo ra natri clorua NaCl.
2Na + Cl2 → 2NaCl
- Trong phản ứng trên, nguyên tử Na nhường electron để biến thành ion Na+, nguyên tử clo hút electron biến thành ion Cl-.
Na → Na+ + 1e
Cl2 + 2e → 2Cl-
- Hai ion mang điện tích trái dấu này hút nhau tạo thành hợp chất ion NaCl.
- Ở đây xảy ra đồng thời sự oxi hóa natri và sự khử clo. Trong phản ứng trên cũng xảy ra sự nhường, sự thu electron và có sự thay đổi số oxi hóa.
Ví dụ 2: Khí hidro cháy trong khí clo tạo ra khí hidro clorua HCl.
\(\overset{0}{H_2}\) + \(\overset{0}{Cl_2}\) → \(\overset{+1-1}{2HCl}\)
- Mỗi nguyên tử H và mỗi nguyên tử Cl góp một electron để hình thành cặp electron chung tạo ra hợp chất cộng hóa trị có cực HCl.
- Trong phân tử HCl, cặp electron chung bị hút lệch về phía nguyên tử Cl, do nguyên tử Cl có độ âm điện lớn hơn.
- Trong phản ứng trên có sự thay đổi số oxi hóa.
Ví dụ 3: Nhiệt phân NH4NO3
![]()
- Nguyên tử nitơ -3 nhường electron còn nguyên tử nitơ +5 nhận electron.
- Chỉ có sự thay đổi số oxi hóa của một nguyên tố.
Kết luận: Các phản ứng trên đều có chung bản chất, đó là sự chuyển electron giữa các chất tham gia phản ứng, chúng đều là các phản ứng oxi hóa khử.
Vậy, phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất phản ứng hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một nguyên tố.
Trong phản ứng oxi hóa khử bao giờ cũng có chất oxi hóa và chất khử tham gia nên luôn xảy ra đồng thời sự oxi hóa và sự khử.
II. CÂN BẰNG PHƯƠNG TRÌNH HÓA HỌC CỦA PHẢN ỨNG OXI HÓA - KHỬ
Phương pháp phổ biến và cơ bản dùng để cân bằng một phương trình hóa học của phản ứng oxi hóa - khử là phương pháp thăng bằng electron.
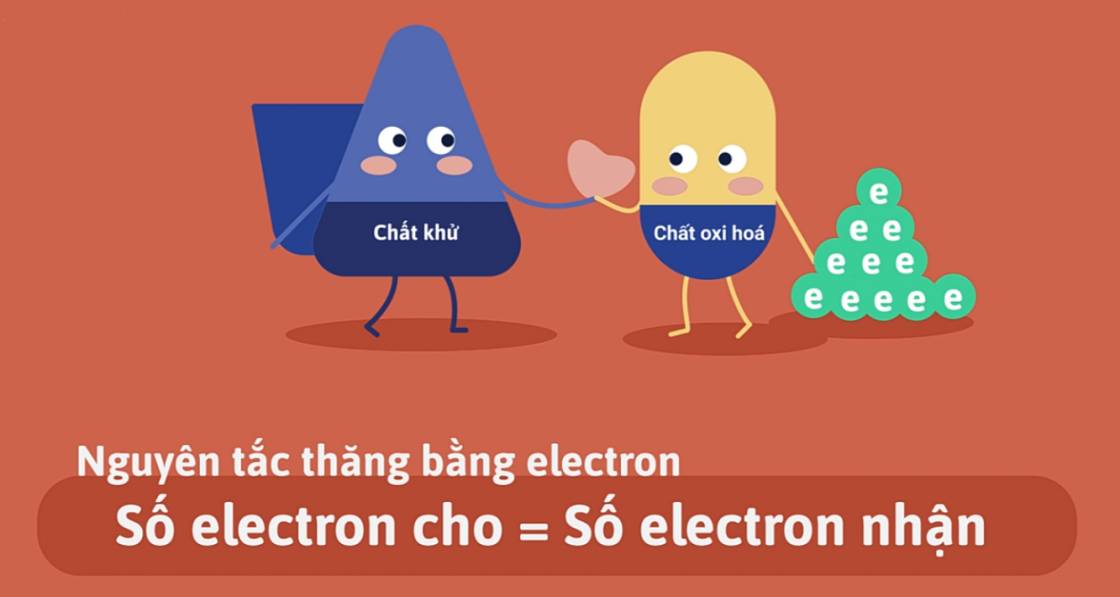
Nguyên tắc của phương pháp: Tổng số electron do chất khử nhường phải đúng bằng tổng số electron và chất oxi hóa nhận.
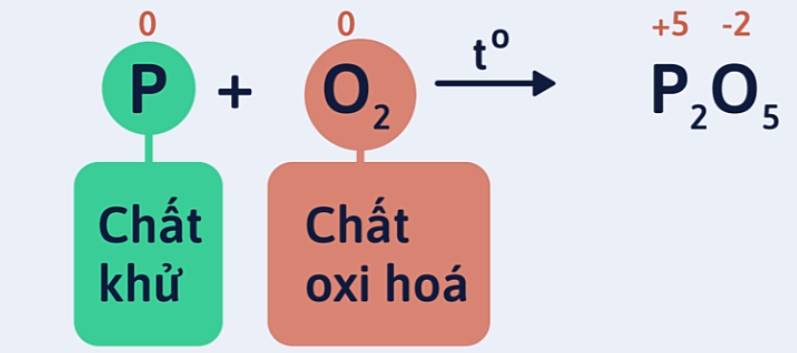
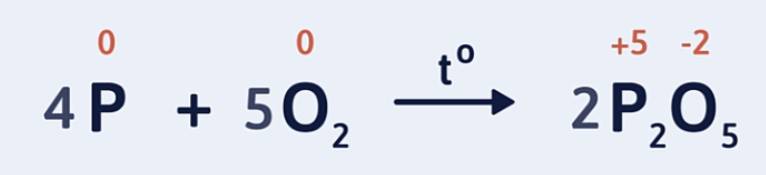
Ví dụ 1: Lập phương trình hóa học của phản ứng P cháy trong O2 tạo ra P2O5 theo sơ đồ phản ứng sau:
P + O2 → P2O5
Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để tìm chất oxi hóa và chất khử.
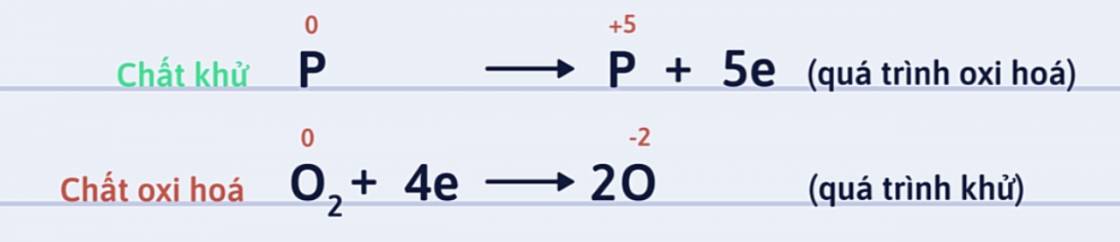
Số oxi hóa của P tăng từ 0 lên +5: P là chất khử.
Số oxi hóa của oxi giảm từ 0 xuống -2: O2 là chất oxi hóa.:
Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
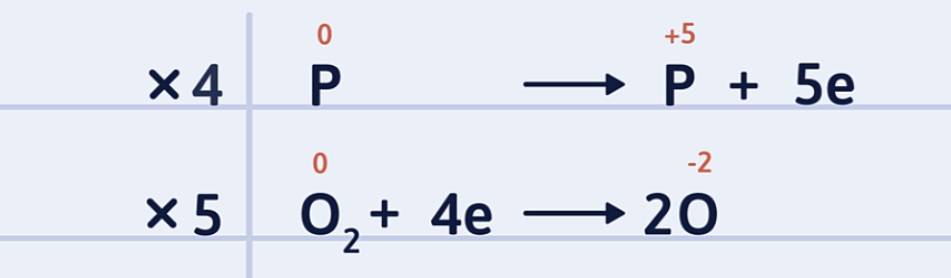
Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Bước 4: Đặt các hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Ví dụ 2: Lập phương trình hóa học của phản ứng khí cacbon monooxit khử sắt (III) oxit ở nhiệt độ cao thành sắt và cacbon đioxit.
Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để tìm chất oxi hóa và chất khử.
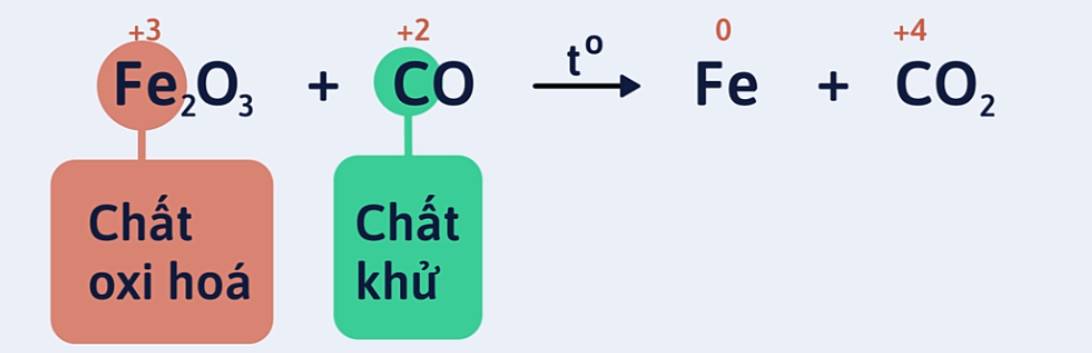
Số oxi hóa của sắt giảm từ +3 xuống 0: Fe trong Fe2O3 là chất oxi hóa.
Số oxi hóa của cacbon tăng từ +2 lên +4: C trong CO là chất khử.
Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
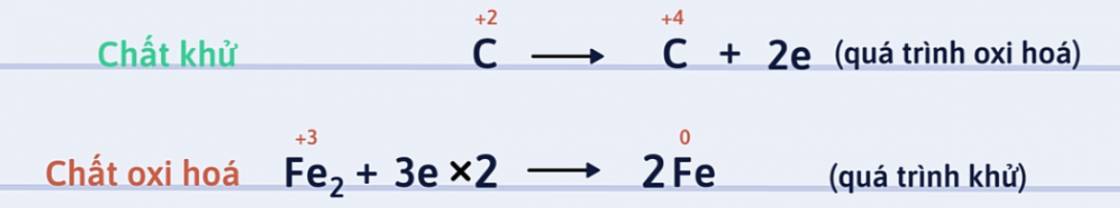
Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
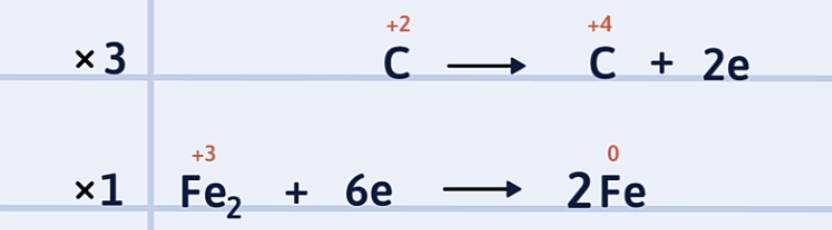
Bước 4: Đặt các hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
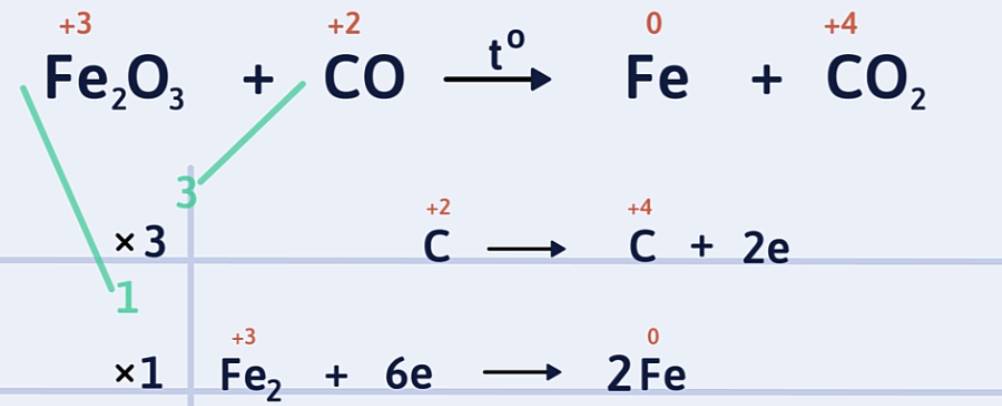
Hoàn thành phương trình hóa học.

III. Ý NGHĨA CỦA PHẢN ỨNG OXH - KHỬ TRONG THỰC TIỄN
Phản ứng oxi hóa - khử là phản ứng hóa học khá phổ biến trong tự nhiên và có tầm quan trọng trong đời sống và sản xuất.
- Trong đời sống, sự cháy của xăng dầu trong các động cơ đốt trong, sự cháy của than, củi, các quá trình điện phân, các phản ứng trong pin, ắc quy... đều là quá trình oxi hóa khử.
- Trong sản xuất, nhiều phản ứng oxi hóa - khử là cơ sở của các quá trình sản xuất hóa học như luyện gang, thép, nhôm, sản xuất các hóa chất cơ bản như xút, axit clohidric, phân bón, thuốc bảo vệ thực vật, dược phẩm, v,v...
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Bạn có thể đăng câu hỏi về bài học này ở đây
