Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Điện phân SVIP
I. Khái niệm và thứ tự điện phân
1. Khái niệm điện phân
- Trong pin điện hóa, điện năng được sinh ra từ phản ứng oxi hóa - khử tự diễn biến. Đối với phản ứng oxi hóa - khử không tự diễn biến, về nguyên tắc có thể làm cho phản ứng xảy ra bằng cách sử dụng dòng điện. Phản ứng này gọi là phản ứng điện phân.
- Điện phân là một quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều với hiệu điện thế đủ lớn đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
Ví dụ 1: Sodium chloride (NaCl) nóng chảy điện li thành các ion Na+ và Cl- chuyển động tự do. Trong điện trường, các ion này sẽ di chuyển về các điện cực trái dấu. Ở một hiệu điện thế đủ lớn, trên bề mặt các điện cực xảy ra các quá trình:
+ Cực âm (cathode): Xảy ra quá trình khử ion Na+:
Na+ + e → Na
+ Cực dương (anode): Xảy ra quá trình oxi hóa Cl-:
2Cl- → Cl2 + 2e
⇒ Phương trình hóa học của phản ứng điện phân NaCl nóng chảy:
2NaCl(l) → 2Na(l) + Cl2(g)
2. Thứ tự điện phân
- Trong trường hợp có nhiều ion cùng dấu xuất hiện tại mỗi điện cực thì thứ tự điện phân các ion đó phụ thuộc vào khả năng nhường hoặc nhận eletron của chúng.
+ Ở cực âm (cathode): Chất có tính oxi hóa mạnh hơn (dễ nhận electron hơn) được ưu tiên điện phân trước.
+ Ở cực dương (anode): Chất có tính khử mạnh hơn (dễ nhường electron hơn) được ưu tiên điện phân trước.
- Khi điện phân dung dịch, nước cũng có thể tham gia điện phân với vai trò chất khử (2H2O → O2 + 4H+ + 4e) hoặc chất oxi hóa (2H2O + 2e → H2 + 2OH-).
Ví dụ 2: Điện phân dung dịch NaCl với các điện cực trơ, có màng ngăn.
+ Trong dung dịch nước, NaCl phân li ra thành Na+ và Cl-.
NaCl(aq) → Na+(aq) + Cl-(aq)
+ Tại anode có Cl- và H2O, trong đó Cl- được ưu tiên điện phân trước.
2Cl-(aq) → Cl2(g) + 2e
+ Tại cathode có Na+ và H2O, trong đó H2O được ưu tiên điện phân trước do dễ nhận electron hơn.
H2O(l) + 2e → H2(g) + 2OH-(aq)
⇒ Phương trình hóa học của phản ứng điện phân:
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2(g) + H2(g)
Khi điện phân dung dịch NaCl bão hòa với điện cực trơ và không có màng ngăn xốp, NaOH sinh ra phản ứng với Cl2 ở anode:
2NaOH(aq) + Cl2(aq) → NaCl(aq) + NaClO(aq) + H2O(l)
Dung dịch sản phẩm thu được gọi là nước Javel có tính tẩy màu.
Thí nghiệm 1: Điện phân dung dịch sodium chloride không màng ngăn để điều chế nước Javel
- Chuẩn bị:
+ Hóa chất: Dung dịch NaCl bão hòa.
+ Dụng cụ: Cốc thủy tinh loại 100 mL, hai điện cực than chì, nguồn điện một chiều 6 V (hoặc pin 6 V), dây dẫn điện.
- Tiến hành: Nhúng hai điện cực vào cốc đựng khoảng 60 mL dung dịch NaCl bão hòa, rồi nối hai điện cực với nguồn điện bằng dây dẫn điện để tiến hành điện phân. Thời gian điện phân tối thiểu 5 phút.
- Chú ý: Không để hai điện cực đã nối nguồn điện chạm vào nhau; đeo khẩu trang và thực hiện thí nghiệm ở nơi thoáng khí hoặc trong tủ hút.
Thí nghiệm 2: Điện phân dung dịch CuSO4 với điện cực than chì.
- Chuẩn bị:
+ Hóa chất: Dung dịch CuSO4 0,5 M.
+ Dụng cụ: Cốc thủy tinh loại 100 mL, hai điện cực than chì, nguồn điện một chiều 6 V (hoặc pin 6 V), dây dẫn điện.
- Tiến hành: Nhúng hai điện cực vào cốc đựng khoảng 60 mL dung dịch CuSO4 rồi nối hai điện cực với nguồn điện một chiều 6 V. Thực hiện điện phân trong tối thiểu 5 phút.
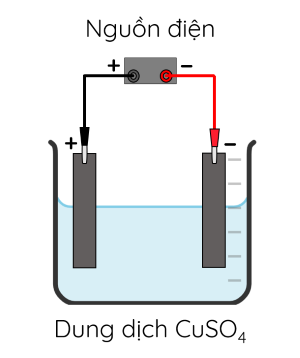
- Chú ý: Không để hai điện cực đã nối nguồn điện chạm vào nhau
II. Ứng dụng của điện phân trong thực tiễn
Điện phân có nhiều ứng dụng quan trọng trong thực tiễn như sản xuất kim loại mạnh (Na, Al,...), mạ điện, tinh chế kim loại,...
Ví dụ 3: Sản xuất Al bằng phương pháp điện phân.
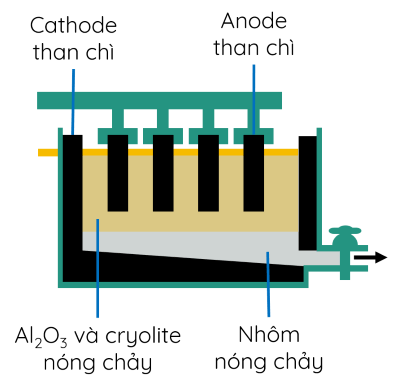
Cryolite được thêm vào hỗn hợp điện phân làm giảm nhiệt độ nóng chảy từ 2072 oC xuống còn khoảng 1000 oC giúp tiết kiệm năng lượng và chi phí chế tạo bể điện phân.
Ví dụ 4: Mạ điện bằng phương pháp điện phân
- Mạ điện là quá trình phủ một lớp khi loại lên bề mặt kim loại khác nhằm trang trí bề mặt hoặc chống sự ăn mòn.

- Trong quá trình mạ điện, vật cần mạ gắn với cực âm của nguồn điện, thanh kim loại mạ gắn với cực dương và cùng nhúng trong dung dịch chứa ion kim loại cần mạ.
- Khi có dòng điện chạy qua, các ion kim loại di chuyển về cực âm, bị khử thành kim loại và phủ lên vật cần mạ.
- Để thu được lớp mạ sáng bóng, độ bám tốt cần chú ý đến các yếu tố như pH, nhiệt độ, thành phần và nồng độ các chất trong dung dịch, mật độ dòng điện,...
Ví dụ 5: Tinh luyện đồng bằng phương pháp điện phân
Đồng có độ tinh khiết cao có khả năng dẫn điện tốt, bền về mặt hóa học nên được sử dụng rộng rãi trong các thiết bị điện tử. Đồng có độ tinh khiết cao có thể thu được từ đồng có độ tinh khiết thấp qua quá trình tinh luyện bằng phương pháp điện phân dung dịch, trong đó:
- Dung dịch chất điện li: CuSO4.
- Anode: Đồng có độ tinh khiết cao.
- Cathode: Đồng có độ tinh khiết thấp.
Khi có dòng điện chạy qua, các ion đồng bị điện phân bám lên cathode tạo thành lớp đồng tinh khiết. Đồng ở anode tan ra, các tạp chất lắng xuống dưới đáy bể dưới dạng "bùn dương cực".
1. Điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
2. Thứ tự điện phân:
- Tại anode: Chất khử mạnh hơn bị oxi hóa trước.
- Tại cathode: Chất oxi hóa yếu mạnh hơn bị khử trước.
3. Điện phân có nhiều ứng dụng quan trọng trong thực tiễn như sản xuất kim loại mạnh (Na, Al,...), mạ điện, tinh chế kim loại,...
Bạn có thể đăng câu hỏi về bài học này ở đây
