Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Đề số 7 SVIP
Yêu cầu đăng nhập!
Bạn chưa đăng nhập. Hãy đăng nhập để làm bài thi tại đây!
Tổng số oxi hóa của các nguyên tử trong SO42- bằng bao nhiêu?
Phản ứng nào dưới đây là phản ứng thu nhiệt?
Điều kiện chuẩn của chất khí ứng với nhiệt độ 298 K và áp suất
Phản ứng nào dưới đây là phản ứng oxi hóa – khử?
Cho các chất sau: O2(g), CO2(g), CH4(g), FeS(s), Al(s), C(graphite), C2H5OH(l). Nhiệt tạo thành của bao nhiêu chất có giá trị bằng không?
Đại lượng nào dưới đây đặc trưng cho mức độ nhanh chậm của phản ứng hóa học?
Trong NO2, số oxi hóa của nguyên tử nitrogen là
Dựa vào dấu biến thiên enthalpy của phản ứng hóa học, biết được phản ứng
Trong phản ứng Fe + 2HCl → FeCl2 + H2, chất khử là
Hằng số tốc độ phản ứng phụ thuộc vào
Sử dụng thông tin sau cho Câu 1 và 2: Trong dung dịch, ion Fe2+ làm mất màu thuốc tím theo sơ đồ sau:
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Phát biểu nào dưới đây không đúng?
Tiến hành chuẩn độ FeSO4 bằng dung dịch KMnO4 0,02 M thu được số liệu như sau:
| Lần chuẩn độ | Thể tích dung dịch FeSO4 (mL) | Thể tích dung dịch KMnO4 (mL) |
|---|---|---|
1 | 5 | 8,7 |
2 | 5 | 8,9 |
3 | 5 | 8,8 |
Nồng độ dung dịch FeSO4 là bao nhiêu?
Phản ứng nhiệt phân 1 mol Cu(OH)2 tạo thành 1 mol CuO và 1 mol nước thu vào nhiệt lượng 9,0 kJ. Phương trình nhiệt hóa học của phản ứng này là
Cho phản ứng hóa học sau: 2SO2 + O2 ⇌ 2SO3. Biểu thức tính tốc độ phản ứng theo định luật tác dụng khối lượng là
Phản ứng đốt cháy ethane là phản ứng tỏa nhiệt, xảy ra như sau:
C2H6(g)+27O2(g)→to2CO2(g)+3H2O(l)
Bất đẳng thức nào dưới đây đúng?
Để làm nóng khẩu phần ăn, người dùng phản ứng giữa CaO và H2O như sau:
CaO(s) + H2O(l) → Ca(OH)2(aq)
ΔrH=−105 kJ
Cần cho bao nhiêu gam CaO vào 250 mL nước để nâng nhiệt độ từ 25 oC lên 80 oC?
Cho biết:
- Nhiệt lượng Q=m.c.ΔT. Trong đó, m là khối lượng (kg), c là nhiệt dung riêng (của nước là 4,2 kJ/(kg.K)), ΔT là biến thiên nhiệt độ (K).
- Khối lượng riêng của nước D = 1 g/mL.
Xét phản ứng: 3O2 → 2O3. Nồng độ ban đầu của oxygen là 0,024 M. Sau 5 giây, nồng độ oxygen còn lại là 0,02 M. Tốc độ trung bình của phản ứng trong khoảng thời gian trên là
Phản ứng đốt cháy khí methane xảy ra như sau:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Cho biết nhiệt tạo thành của CH4, CO2 và H2O lần lượt là -75; -393,5; -285,8 kJ/mol. Nhiệt tỏa ra khi đốt cháy 12 kg methane là
Quang hợp là quá trình lá cây sử dụng nước và khí carbon dioxide nhờ năng lượng ánh sáng đã được diệp lục hấp thụ để tổng hợp chất hữu cơ và giải phóng oxygen. Phản ứng quang hợp được biểu diễn theo sơ đồ sau:
CO2 + H2O ⇢ C6H12O6 + O2
(Nhấp vào ô màu vàng để chọn đúng / sai)| a) Số oxi hóa của oxygen trong O2 là -2. |
|
| b) Trong phản ứng quang hợp, CO2 là chất khử. |
|
| c) Tổng hệ số của các chất trong phương trình là 18. |
|
| d) Để tổng hợp được 1 kg glucose, lá cây cần hấp thụ 826,33 lít khí CO2 (đkc) trong quá trình quang hợp. |
|
Thành phần chính của khí gas là propane (C3H8) và butane (C4H10) cùng một số thành phần khác như chất tạo mùi đặc trưng methanethiol (CH3SH) có mùi giống tỏi, hành tây. Bình gas 12 kg thường được sử dụng trong các hộ gia đình có tỉ lệ thể tích C3H8 : C4H10 là 30 : 70. Cho biết:
C3H8(g)+ 5O2(g)→to3CO2(g)+4H2O(l)
ΔrH298o=−2220 kJ
C4H10(g)+213O2(g)→to4CO2(g)+5H2O(l)
ΔrH298o=−2874 kJ
(Nhấp vào ô màu vàng để chọn đúng / sai)| a) Phản ứng đốt cháy propane và butane đều là phản ứng thu nhiệt. |
|
| b) Việc pha trộn thêm chất tạo mùi đặc trưng vào khí gas giúp phát hiện sự cố rò rỉ. |
|
| c) Nhiệt lượng tỏa ra khi đốt cháy 1 mol butane là 2874 kJ. |
|
| d) Một hộ gia đình cần 5000 kJ nhiệt mỗi ngày thì sử dụng hết bình gas 12 kg trong 60 ngày (giả sử hiệu suất hấp thụ nhiệt là 80%). |
|
Thực hiện phản ứng sau:
CaCO3 + 2HCl ⟶ CaCl2 + CO2 + H2O
Đo thể tích khí CO2 thoát ra ở áp suất khí quyển và nhiệt độ phòng theo thời gian thu được đồ thị như sau:
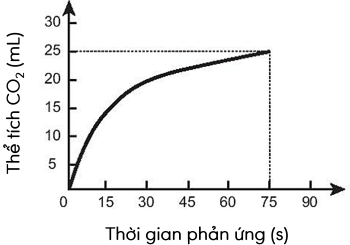
| a) Phản ứng diễn ra trong 75 giây. |
|
| b) Tại thời điểm t = 90 s, tốc độ phản ứng bằng không. |
|
| c) Theo thời gian, tốc độ phản ứng tăng dần. |
|
| d) Tốc độ trung bình của phản ứng là 0,33 mL/s. |
|
Ethanol (CH3CH2OH) và dimethyl ether (CH3OCH3) là đồng phân của nhau, chúng có cùng công thức phân tử là C2H6O. Cho quá trình chuyển hóa giữa hai đồng phân này như sau:
H3C – CH2 – OH(g) ⟶ H3C – O – CH3(g)
Cho năng lượng liên kết trong bảng sau:
| Liên kết | Eb (kJ/mol) |
|---|---|
C – C | 346 |
C – O | 360 |
C – H | 418 |
O – H | 459 |
| a) Trong một phân tử ethanol có một liên kết O – H. |
|
| b) Trong phân tử dimethyl ether chỉ có liên kết C – H và liên kết C – O. |
|
| c) Chuyển hóa ethanol thành dimethyl ether là quá trình thu nhiệt. |
|
| d) Ở điều kiện chuẩn, ethanol bền hơn dimethyl ether. |
|
Cho các chất sau: MnCl2, MnO2, KMnO4, K2MnO4. Chất có chứa nguyên tử manganese với số oxi hóa lớn nhất có phân tử khối là bao nhiêu amu (làm tròn kết quả đến chữ số hàng đơn vị)?
Trả lời: .
Phản ứng giữa khí nitrogen và oxygen chỉ xảy ra ở nhiệt độ cao hoặc nhờ tia lửa điện:
N2(g)+O2(g)→to2NO(g)
Biến thiên enthalpy chuẩn của phản ứng được tính theo biểu thức sau:
ΔrH298o=x.Eb(N≡N)+y.Eb(O=O)−z.Eb(N=O)
Giá trị x + y + z bằng bao nhiêu (làm tròn kết quả đến chữ số hàng đơn vị)?
Trả lời: .
Cho các phản ứng hóa học sau:
(1) 2H2SO4 + 2Cu + O2 ⟶ 2CuSO4 + 2H2O
(2) FeS + H2SO4 ⟶ FeSO4 + H2S
(3) 3H2SO4 + 2Al ⟶ Al2(SO4)3 + 3H2
(4) 3H2SO4 + Zn ⟶ ZnSO4 + SO2 + 3H2O
(5) K2Cr2O7 + 3FeSO4 + 4H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 4H2O.
(6) H2SO4 + CaCO3 ⟶ CaSO4 + CO2 + H2O
Có bao nhiêu phản ứng mà H2SO4 đóng vai trò là chất oxi hóa?
Trả lời: .
Một học sinh tiến hành phản ứng sau và ghi lại thể tích khí SO2 thoát ra theo thời gian:
H2SO4 + Na2S2O3 ⟶ Na2SO4 + SO2 + S + H2O
| Thời gian (s) | Thể tích SO2 (mL) |
|---|---|
0 | 0,0 |
10 | 12,5 |
20 | 20,0 |
30 | 26,5 |
40 | 31,0 |
50 | 32,5 |
Tốc độ trung bình của phản ứng trong 20 s cuối bằng bao nhiêu lần tốc độ trung bình của phản ứng ở 20 s đầu (chỉ làm tròn kết quả của phép tính cuối cùng đến chữ số hàng phần mười)?
Trả lời: .
Một người thợ xây trong buổi sáng kéo được 500 kg vật liệu xây dựng lên tầng cao 10 mét. Để bù vào năng lượng đã tiêu hao, người đó cần uống cốc nước hòa tan m gam glucose. Cho biết:
- Nhiệt tạo thành của glucose (C6H12O6), CO2 và H2O lần lượt là -1271; -393,5; -285,8 kJ/mol.
- Phản ứng phân hủy glucose xảy ra như sau:
C6H12O6 + 6O2 ⟶ 6CO2 + 6H2O
- Bỏ qua ma sát, để kéo vật lên cao, cần thực hiện một công cơ học có giá trị bằng thế năng hấp dẫn của vật sau khi vật được nâng lên cao: A = Et = m.g.h (m là khối lượng vật (kg), g = 9,8 m/s2 là gia tốc trọng trường, h là độ cao (m)).
Giá trị của m là bao nhiêu (chỉ làm tròn kết quả của phép tính cuối cùng đến chữ số hàng phần trăm)?
Trả lời: .
Khí SO2 có khả năng làm mất màu dung dịch thuốc tím KMnO4 theo sơ đồ sau:
SO2 + KMnO4 + H2O ⇢ H2SO4 + K2SO4 + MnSO4
Dẫn khí SO2 từ từ lội qua 100 mL dung dịch KMnO4 0,02 M đến khi vừa mất màu tím. Thể tích khí SO2 cần dùng ở điều kiện chuẩn là bao nhiêu lít (làm tròn kết quả đến chữ số hàng phần trăm)?
Trả lời: .
