Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Đại cương về kim loại chuyển tiếp dãy thứ nhất SVIP
1. ĐẶC ĐIỂM CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ KIM LOẠI CHUYỂN TIẾP DÃY THỨ NHẤT
Kim loại chuyển tiếp dãy thứ nhất gồm các nguyên tố từ Sc (Z = 21) đến Cu (Z = 29).
Câu hỏi:
@202874618271@
- Đặc điểm cấu hình electron nguyên tử:
+ Lớp vỏ bên trong của khí hiếm Ar.
+ Số electron trên phân lớp 3d tăng dần từ 1 đến 10.
+ Trên phân lớp 4s, số electron bằng 2 (trừ Cr và Cu bằng 1).
+ Nguyên tử của kim loại chuyển tiếp có nhiều electron hóa trị.
2. MỘT SỐ TÍNH CHẤT VẬT LÍ VÀ ỨNG DỤNG CỦA KIM LOẠI CHUYỂN TIẾP DÃY THỨ NHẤT
➤ Một số tính chất vật lí
Kim loại chuyển tiếp thường có nhiệt độ nóng chảy cao, độ cứng lớn, khối lượng riêng lớn, dẫn điện và dẫn nhiệt tốt.
➤ Một số ứng dụng
Kim loại chuyển tiếp thường được ứng dụng trong sản xuất thiết bị chịu nhiệt, công cụ cắt gọt, dây dẫn và thiết bị truyền nhiệt.
|
|
|
|
3. TRẠNG THÁI OXI HÓA VÀ MÀU SẮC CỦA ION KIM LOẠI CHUYỂN TIẾP DÃY THỨ NHẤT
➤ Trạng thái oxi hóa, cấu hình electron của một số ion kim loại chuyển tiếp dãy thứ nhất
Các nguyên tố chuyển tiếp dãy thứ nhất có nhiều electron hóa trị (phân lớp 3d và 4s) nên khả năng tạo ra các hợp chất với nhiều trạng thái oxi hóa khác nhau.
Câu hỏi:
@202874615995@
Một số trạng thái oxi hóa thường gặp của kim loại chuyển tiếp dãy thứ nhất:
Nguyên tử | Cr | Mn | Fe | Cu |
Số oxi hóa | +3 +6 | +2 +4 +7 | +2 +3 | +2 |
Khi tham gia phản ứng, kim loại chuyển tiếp dãy thứ nhất thường nhường electron 4s trước rồi đến 3d để tạo các cation tương ứng.
Ví dụ:
Fe | → | Fe2+ | + | 2e |
[Ar]3d64s2 |
| [Ar]3d6 |
|
➤ Màu sắc của một số ion trong dung dịch
Các ion kim loại chuyển tiếp dãy thứ nhất có màu sắc phong phú.
Ví dụ:
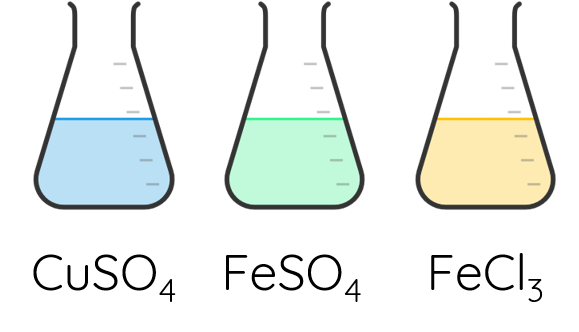
4. THÍ NGHIỆM
➤ Thí nghiệm xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím
Phản ứng chuẩn độ iron(II) sulfate bằng thuốc tím:
\(10FeSO_4+2KMnO_4+8H_2SO_4\rightarrow5Fe_2\left(SO_4\right)_3+2MnSO_4+K_2SO_4+8H_2O\)
⚡THÍ NGHIỆM (Xác định nồng độ của dung dịch FeSO4 bằng dung dịch thuốc tím)
- Lắp bộ dụng cụ như hình minh họa và rót dung dịch thuốc tím vào burette đến vạch 0.
- Cho 10 mL dung dịch FeSO4 và 5 mL dung dịch H2SO4 20% vào bình tam giác.

- Mở khóa burette cho thuốc tím nhỏ giọt từ từ vào bình và lắc đều. Khi màu hồng xuất hiện và bền trong khoảng 20 giây thì dừng chuẩn độ. Ghi thể tích thuốc tím đã dùng và lặp lại ít nhất 3 lần.

Câu hỏi:
@205200424499@
➤ Thí nghiệm nhận biết sự có mặt của từng ion Cu2+, Fe2+ riêng biệt
Các ion kim loại chuyển tiếp có thể được nhận biết nhờ màu sắc đặc trưng, sự tạo kết tủa ít tan hoặc phản ứng tạo phức chất.
⚡ THÍ NGHIỆM (Kiểm tra sự có mặt của từng ion riêng biệt: Cu2+ và Fe3+)
Nhận biết ion Fe3+ bằng dung dịch kiềm
Thêm từ từ NaOH 0,5 M vào ống nghiệm chứa 1 mL dung dịch FeCl3 0,5 M.

Nhận biết ion Cu2+ bằng dung dịch kiềm
Thêm từ từ NaOH 0,5 M vào ống nghiệm chứa 1 mL dung dịch CuSO4 0,5 M.

Câu hỏi:
@205395174536@
Bạn có thể đăng câu hỏi về bài học này ở đây


 Mũi khoan làm từ hợp kim của chromium
Mũi khoan làm từ hợp kim của chromium Dây điện làm từ kim loại đồng
Dây điện làm từ kim loại đồng Gang làm từ hợp kim của sắt
Gang làm từ hợp kim của sắt