Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Ammonia và một số hợp chất ammonium SVIP
1. CẤU TẠO PHÂN TỬ AMMONIA
Phân tử ammonia có cấu trúc dạng hình chóp tam giác, gồm ba liên kết cộng hóa trị phân cực N-H và một cặp electron không liên kết trên nguyên tử nitrogen.

2. TÍNH CHẤT CỦA AMMONIA
➤ Tính chất vật lí
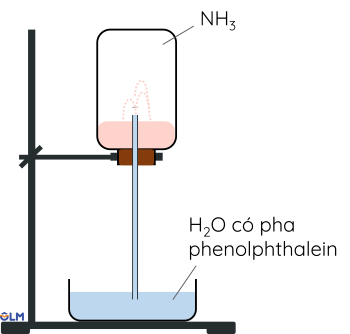
Ammonia là khí không màu, mùi khai, nhẹ hơn không khí và dễ tan trong nước nhờ liên kết hydrogen.
Thí nghiệm tính tan của ammonium trong nước:
Câu hỏi:
@202981759884@
➤ Tính chất hóa học
Ammonia có tính khử và tính base.
- Ammonia tan trong nước tạo thành dung dịch có tính base yếu do có khả nhận proton. Dung dịch ammonia có thể làm quỳ tím hóa xanh và phenolphathlein chuyển sang màu hồng.
\(NH_3+H_2O⇌NH_4^++OH^-\)
- Ammonia phản ứng với acid tạo thành muối ammonium:
\(NH_3+HCl\rightarrow NH_4Cl\)
- Ammonia có thể cháy trong khí oxygen:
\(4NH_3+3O_2\overset{t^o}{\rightarrow}2N_2+6H_2O\)
- Ammonia bị oxi hóa bởi oxygen ở nhiệt độ cao (800 - 900 oC) với xúc tác Pt:
\(4NH_3+5O_2\overset{Pt,t^o}{\rightarrow}4NO+6H_2O\)
Câu hỏi:
@205885381252@
3. TỔNG HỢP AMMONIA
Trong công nghiệp, ammonia được tổng hợp theo quá trình Haber - Bosch ở 400 - 600 oC, 200 bar với xúc tác bột sắt.
\(N_2\left(g\right)+3H_2\left(g\right)\overset{t^{o},p,xt}{\rightleftharpoons}2NH_3\left(g\right)\) \(\Delta_{r}H^{o}=-91,8\) \(kJ\)
Trong quá trình Haber - Bosch, hỗn hợp nitrogen và hydrogen được nén ở áp suất cao, đun nóng và cho qua xúc tác sắt. Ammonia sinh ra được ngưng tụ bằng cách làm lạnh để tách ra khỏi hỗn hợp, phần khí chưa phản ứng được tuần hoàn trở lại buồng phản ứng.

Sơ đồ của quá trình Haber - Bosch
Câu hỏi:
@205868526528@
4. MUỐI AMMONIUM
➤ Tính chất vật lí của muối ammonium
Hầu hết muối ammonium tan tốt trong nước và phân li hoàn toàn tạo thành ion.
Các muối ammonium thường gặp: NH4Cl, NH4NO3, NH4ClO4, NH4HCO3, (NH4)2SO4, NH4H2PO4, (NH4)2HPO4, (NH4)2Cr2O7.
Câu hỏi:
@205885474265@
➤ Tính chất hóa học của muối ammonium
Muối ammonium phản ứng với dung dịch kiềm khi đun nóng tạo thành khí NH3 có mùi khai đặc trưng. Đây là dấu hiệu nhận biết ion NH4+.
⚡ THÍ NGHIỆM (Nhận biết ion ammonium trong phân đạm)
- Thêm 2 mL nước cất vào ống nghiệm chứa 2 gam phân đạm ammonium và lắc đều cho đến khi tan hết.

- Thêm 2 mL dung dịch NaOH đặc vào ống nghiệm.

- Đun nóng nhẹ trên đèn cồn và đưa mẩu giấy pH ẩm vào miệng ống nghiệm.

Câu hỏi:
@205885486156@
Khi bị nung nóng, muối ammonium dễ dàng phân hủy do kém bền nhiệt.
Ví dụ:
\(NH_4Cl\overset{t^o}{\rightarrow}NH_3+HCl\)
\(NH_4HCO_3\overset{t^o}{\rightarrow}NH_3+CO_2+H_2O\)
\(NH_4NO_3\overset{t^o}{\rightarrow}N_2O+H_2O\)
5. ỨNG DỤNG
Ammonia và muối ammonium được ứng dụng rộng rãi trong đời sống và sản xuất.
➤ Ứng dụng của ammonia
Trong công nghiệp, ammonia được dùng để điều chế HNO3, sản xuất phân bón, dung môi và chất làm lạnh.
➤ Ứng dụng của muối ammonium
- Ammonium nitrate (NH4NO3) là loại phân bón phổ biến, giúp cây trồng phát triển nhanh.
- Các muối ammonium khác được dùng trong sản xuất phân đạm và phân bón tổng hợp.

Phân đạm
Bạn có thể đăng câu hỏi về bài học này ở đây
