Trong công nghiệp sunfuric axit được sản xuất bằng phương pháp tiếp xúc theo sơ đồ phản ứng a viết phương trình hóa học của các phản ứng xảy ra trong quy trình trên b giai đoạn 2 là giai đoạn quan trọng nhất của chu trình sản xuất sunfuric axit giả sử trong bình phản ứng dung tích 1 lít ban đầu có 0,4 mol SO2 và 0,6 mol o2 được giữ ở nhiệt độ không đổi khi đạt đến trạng thái cân bằng lượng SO3 trong bình là 0,3 mol tính hằng số cân bằng của phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi CTPT của X là CxHyOz.
x:y:z=40%12:6,67%1:53,33%16=1:2:1.
CTPT của X là (CH2O)n, mà MX=60 g/mol. Suy ra X là C2H4O2.

Ta có:
| 2SO2 (g) | + | O2 (g) | ⇌ | 2SO3 (g) | |
| Ban đầu (M): | 0,4 | 0,6 | |||
| Phản ứng (M): | 0,3 | 0,15 | 0,3 | ||
| Cân bằng (M): | 0,1 | 0,45 | 0,3 |
⇒ Hằng số cân bằng của phản ứng: Kc = (0,3x0,3) : (0,1x0,1x0,45) = 20KC=[SO3]2[SO2]2[O2]=0,320,12.0,45=20KC=[SO2]2[O2][SO3]2=0,12.0,450,32=20

(1) \(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
(2) \(2SO_2+O_2\xrightarrow[_{V_2O_5}]{^{t^o}}2SO_3\)
(3) \(nSO_3+H_2SO_4\rightarrow H_2SO_4.nSO_3\)
(4) \(H_2SO_4.nSO_3+nH_2O\rightarrow\left(n+1\right)H_2SO_4\)
a) 4FeS2 + 11O2 → 2Fe2O3 +8SO2 (1)
Phản ứng (1) là phản ứng oxi hoá - khử; chất oxi hoá: O2; chất khử: FeS2
2SO2 + O2 →𝑡𝑜,𝑉2𝑂5 2SO3 (2)
Phản ứng (2) là phản ứng oxi hoá - khử; chất oxi hoá: O2; chất khử: SO2
SO3 + H2O → H2SO4 (3)
Phản ứng (3) không là phản ứng oxi hoá - khử
b) 1 tấn quặng chứa 60% FeS2 (M = 120 g/𝑚𝑜𝑙−1)
Số mol FeS2 trong 1 tấn quặng trên là: 106120.60100= 5000 mol
Sơ đồ phản ứng: FeS2 → 2SO2 → 2SO3 → 2H2SO4
Dựa trên sơ đồ có số mol H2SO4 là 2.5000 = 10 000 mol.
Khối lượng H2SO4 thu được là:
98 × 10 000 = 980 000 gam = 980 kg = 0,98 tấn.
Khối lượng H2SO4 98% thu được là: 0,9898.100=1tấn.
Do hiệu suất cả quá trình là 80% nên khối lượng H2SO4 98% thực tế thu được là:
1.80100=0,8 tấn.
c) Trong FeS2 nguyên tố S có số oxi hóa -1, đề xuất công thức cấu tạo là:

a, \(N_2+3H_2⇌2NH_3\)
b, Ta có: \(K_c=\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\left[H_2\right]^3}=\dfrac{0,62^2}{0,45.0,14^3}\approx311,31\)
c, - Tăng nhiệt độ → giảm hiệu suất.
- Tăng áp suất → tăng hiệu suất.
- Thêm bột sắt (xúc tác) → không làm thay đổi hiệu suất.
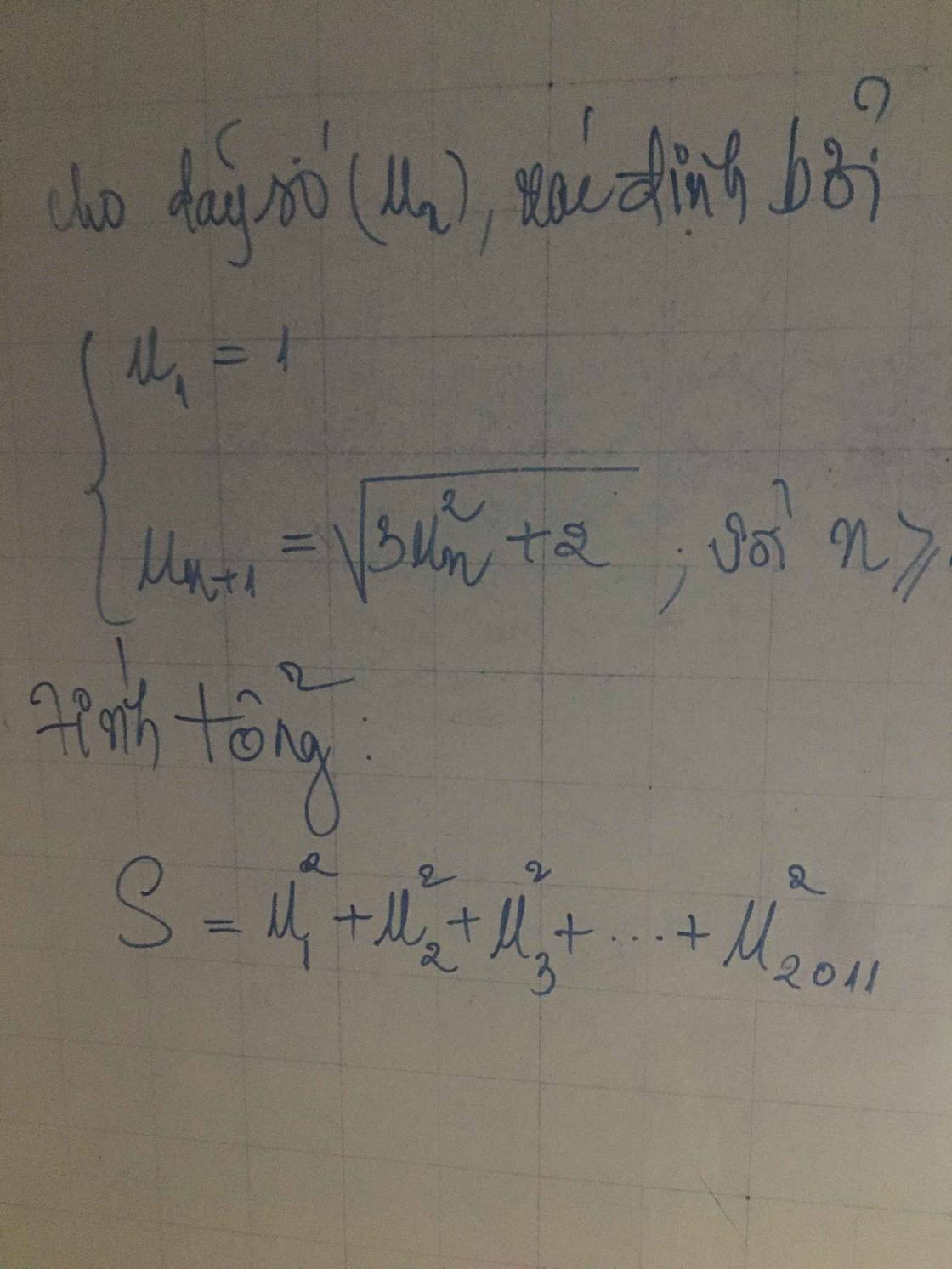
.gif)
.gif)

