(1 điểm) Phương trình ion thu gọn cho biết bản chất của phản ứng trong dung dịch chất điện li. Ví dụ phản ứng nhận biết ion ammonium bằng dung dịch kiềm có bản chất là
NH4+ + OH- → NH3 + H2O
Cách chuyển phương trình phân tử thành phương trình ion thu gọn như sau:
- Chuyển các chất vừa dễ tan trong nước vừa điện li mạnh thành ion; các chất khí, kết tủa, điện li yếu, không điện li và...
Đọc tiếp
(1 điểm) Phương trình ion thu gọn cho biết bản chất của phản ứng trong dung dịch chất điện li. Ví dụ phản ứng nhận biết ion ammonium bằng dung dịch kiềm có bản chất là
NH4+ + OH- → NH3 + H2O
Cách chuyển phương trình phân tử thành phương trình ion thu gọn như sau:
- Chuyển các chất vừa dễ tan trong nước vừa điện li mạnh thành ion; các chất khí, kết tủa, điện li yếu, không điện li và nước để nguyên dạng phân tử.
Ví dụ: NH4Cl + NaOH → NaCl + NH3 + H2O
⇒ NH4+ + Cl- + Na+ + OH- → Na+ + Cl- + NH3 + H2O
- Lược bỏ những ion không tham gia phản ứng (các ion xuất hiện ở cả trước và sau phản ứng).
⇒ Lược bỏ ion Na+ và Cl-
⇒ NH4+ + OH- → NH3 + H2O
Từ đó, em hãy viết phương trình ion thu gọn của các phản ứng hóa học sau.
a) NaOH + HCl → NaCl + H2O
b) BaCl2 + Na2SO4 → 2NaCl + BaSO4↓
c) K2CO3 + 2HCl → 2KCl + CO2 + H2O
d) Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + Cu(NO3)2

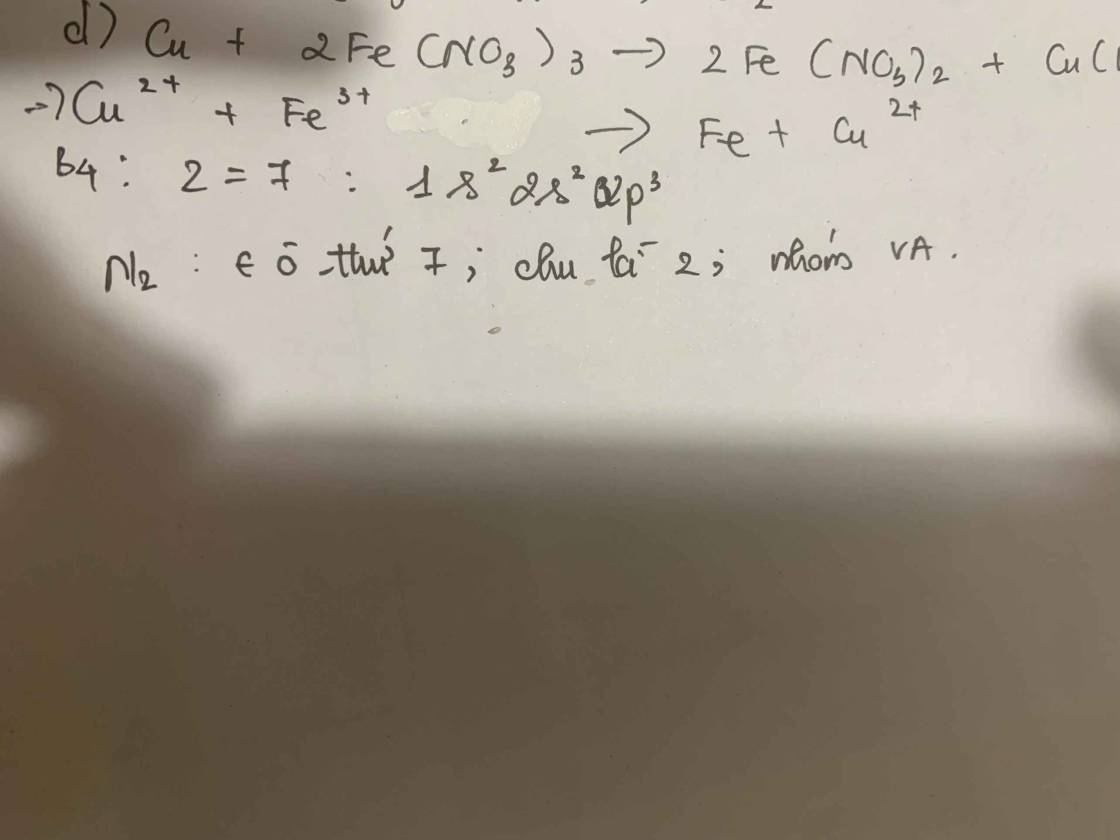
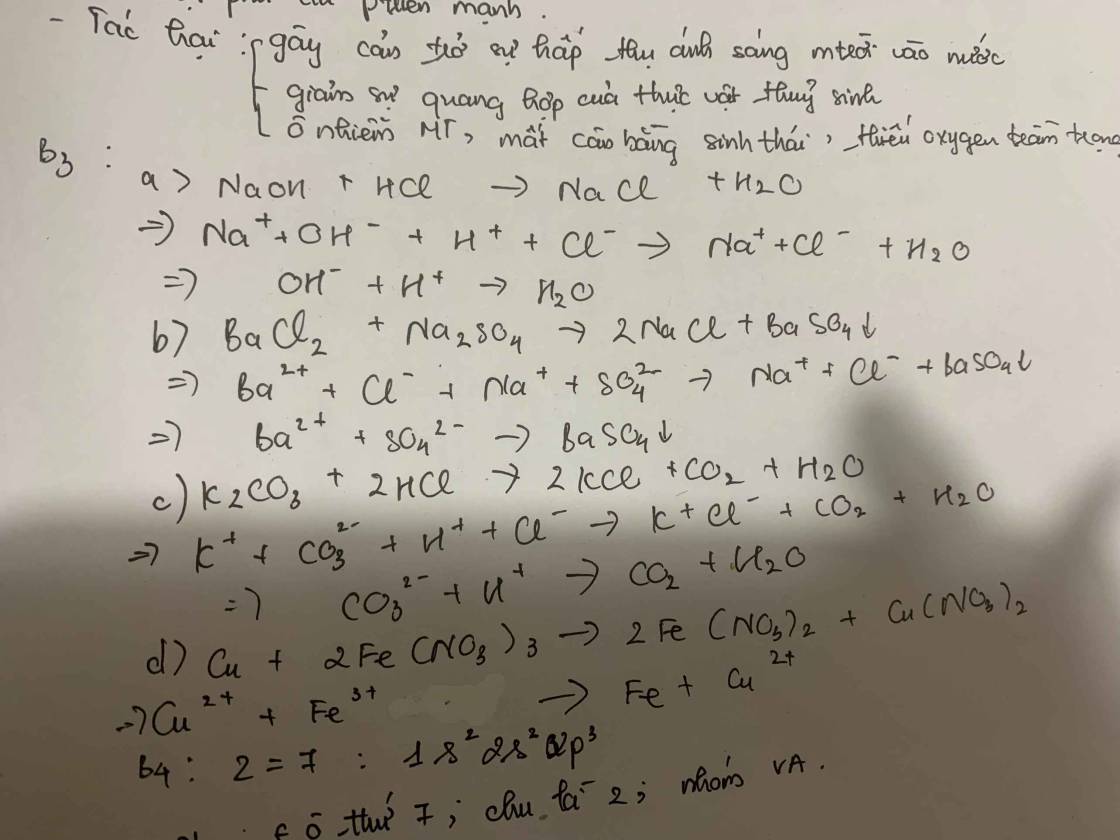
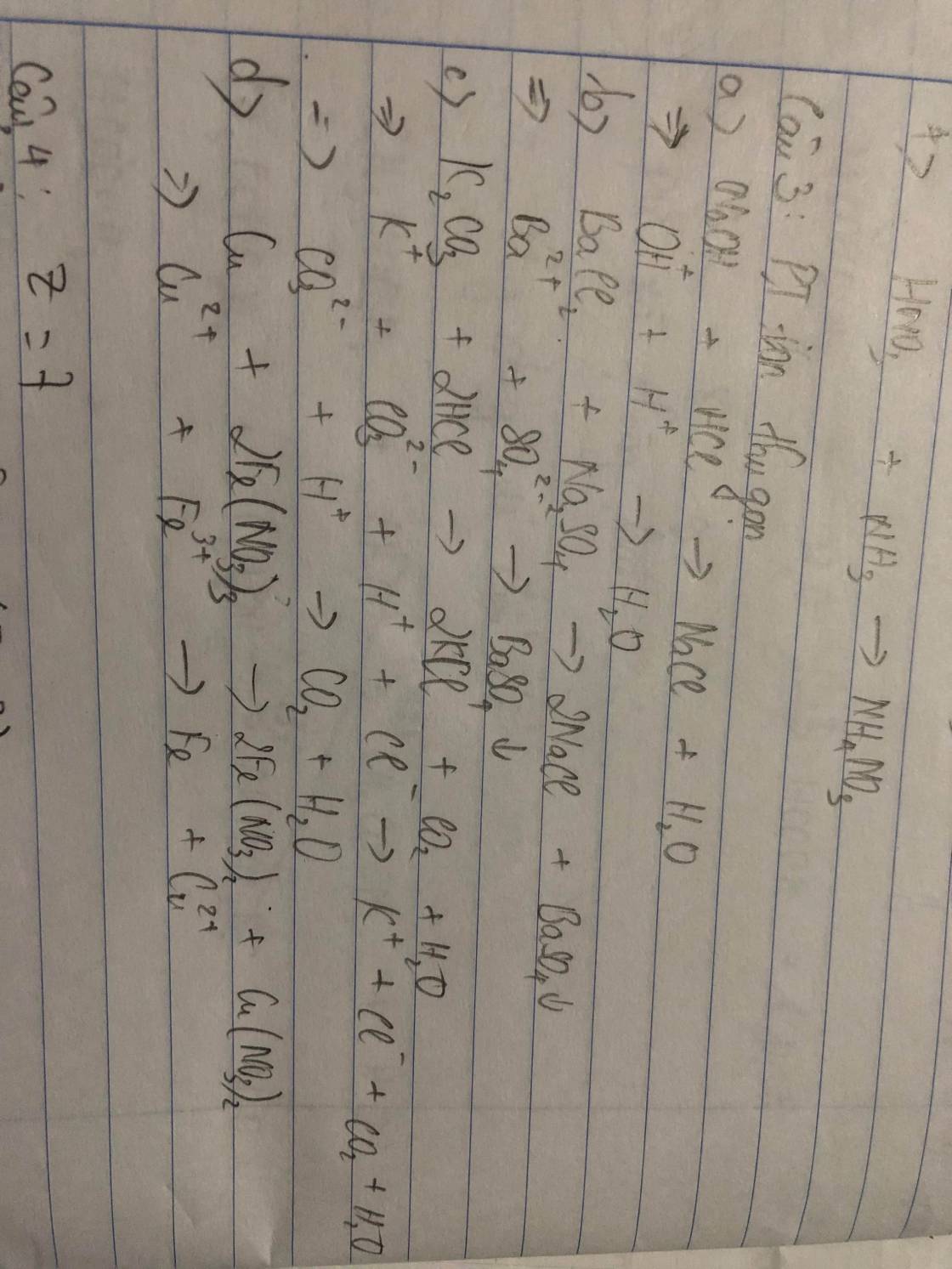

a) N2 (k) + 3H2 (k) ⇄ 2NH3 (k)
b) ta có : kc = \(\dfrac{\left[NH3\right]^2}{\left[N_2\right].\left[H_2\right]^3}=\dfrac{0.62^2}{0.45.0.14^3}33=311,3\)
c) - Tăng nhiệt độ: Hiệu suất phản ứng Giảm ( ta ví chiều thuận là chiều tăng hiệu suất phản ứng, khi tăng nhiệt độ cân bằng dịch chuyển theo chiều thu nhiệt là chiều nghịch => hiệu suất giảm)
- Tăng áp suất : Hiệu suất phản ứng tăng ( Khi tăng áp suất cân bằng dịch chuyển theo chiều làm giảm số mol khí, ta thấy vế trái có hệ 2, vế phải có hệ 3 vậy cân bằng dịch chuyển theo chiều thuận => hiệu suất tăng)
- Thêm lượng bột sắt : Không làm ảnh hưởng đến hiệu suất phản ứng ( fe là chất xúc tác khi thêm nó sẽ không làm cân bằng chuyển dịch)
KC=[NH3]2[N2].[H2]3
KC=[NH3]2[N2].[H2]3KC=[NH3]2[N2].[H2]
phần trả lời của mình bị lỗi 2 con số 3 khi tính hằng số.