(1,5 điểm) Trang đi học lúc 7 giờ 15 phút và dự định đến trường lúc 7 giờ 35 phút. Hôm nay, đi khỏi nhà được 500 m thì Trang phải quay về lấy 1 quyển vở để quên. Vì vậy, khi Trang đến trường thì đã là 7 giờ 50 phút. Hỏi vận tốc của Trang là bao nhiêu ki-lô-mét trên giờ, biết rằng vận tốc đó không thay đổi?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\frac{8}{25}giờ+\) \(14,4phút+26\%giờ+\) \(10,8phút\)
= 19,2 phút + 14,4 phút + 15,6 phút + 10,8 phút
= 19,2 phút + 10,8 phút + 14,4 phút + 15,6 phút
= (19,2 phút + 10,8 phút)+(14,4 phút + 15,6 phút)
= 20 phút + 30 phút
= 50 phút
8/25 giờ + 14,4 phút + 26% giờ + 10,8 Phút
= 19,2 giờ + 14,4 phút + 15,6 phút + 10,8 phút
= ( 14,4 phút + 15,6 phút ) + ( 19,2 giờ + 10,8 phút )
= 30 phút + 30 phút
= 60 phút
đổi thành : 60 phút = 1 giờ
- 8/25 giờ = 8 : 25 \(*\) 60 = 19,2
- 26% =26 \(*\) 60 : 100 = 15,6

Trả lời:
a)9 phút 17 giây +6 phút 42 giây=15 phút 59 giây
b)17 năm 5 tháng - 8 năm 8 tháng=8 năm 9 tháng
c)10 năm 3 tháng x 6=61 năm 6 tháng
d)35 giờ 52 phút :4=8 giờ 58 phút ⚡
a)9 phút 17 giây +6 phút 42 giây=15 phút 59 giây
b)17 năm 5 tháng - 8 năm 8 tháng=8 năm 9 tháng
c)10 năm 3 tháng x 6=61 năm 6 tháng
d)35 giờ 52 phút :4=8 giờ 58 phút

- Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa đỏ: HCl
+ Quỳ hóa xanh: NaOH
+ Quỳ không đổi màu: NaCl
- Dán nhãn.
hcl đổi màu quỳ tím thành đỏ
Naoh đổi màu quỳ tím thành XAnh
Nacl làm quỳ tím không chuyển màu

a, \(CaCO_3+2CH_3COOH\rightarrow\left(CH_3COO\right)_2Ca+CO_2+H_2O\)
b, Ta có: \(n_{CO_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
Theo PT: \(n_{CH_3COOH}=2n_{CO_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=0,2.100=20\left(g\right)\)
c, \(n_{\left(CH_3COO\right)_2Ca}=n_{CO_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{\left(CH_3COO\right)_2Ca}=0,1.158=15,8\left(g\right)\)

\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
0,2 0,2 0,2 0,2
số mol CuO là: \(n_{CuO}=\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{16}{80}=0,2\left(g\right)\)
khối lượng chất tan \(H_2SO_4\text{ là: }\)
\(m_{H_2SO_4}=n_{H_2SO_4}\cdot M_{H_2SO_4}=0,2\cdot98=19,6\left(g\right)\)
nồng độ phần trăm dung dịch \(H_2SO_4\text{ là: }\)
\(C\%=\dfrac{m_{ct}}{m_{dd}}\cdot100\%=\dfrac{19,6}{150}\cdot100\%\approx13,07\%\)

Có 2 đồng phân là : C nối 3 CH nối 2 CH2
CH2 nối 2 C nối 2 CH2

Mol của kim loại Al: N al= 5.4:27=0,2(mol)
PTHH: Al+HCl->H2+AlCl3.
a) Nồng độ mol: Cm HCl= 0,2 : 0,15= ( xấp xỉ) 1,33(M)
b) V khí H2= 0,2 x 24,79= 4,958 (l)
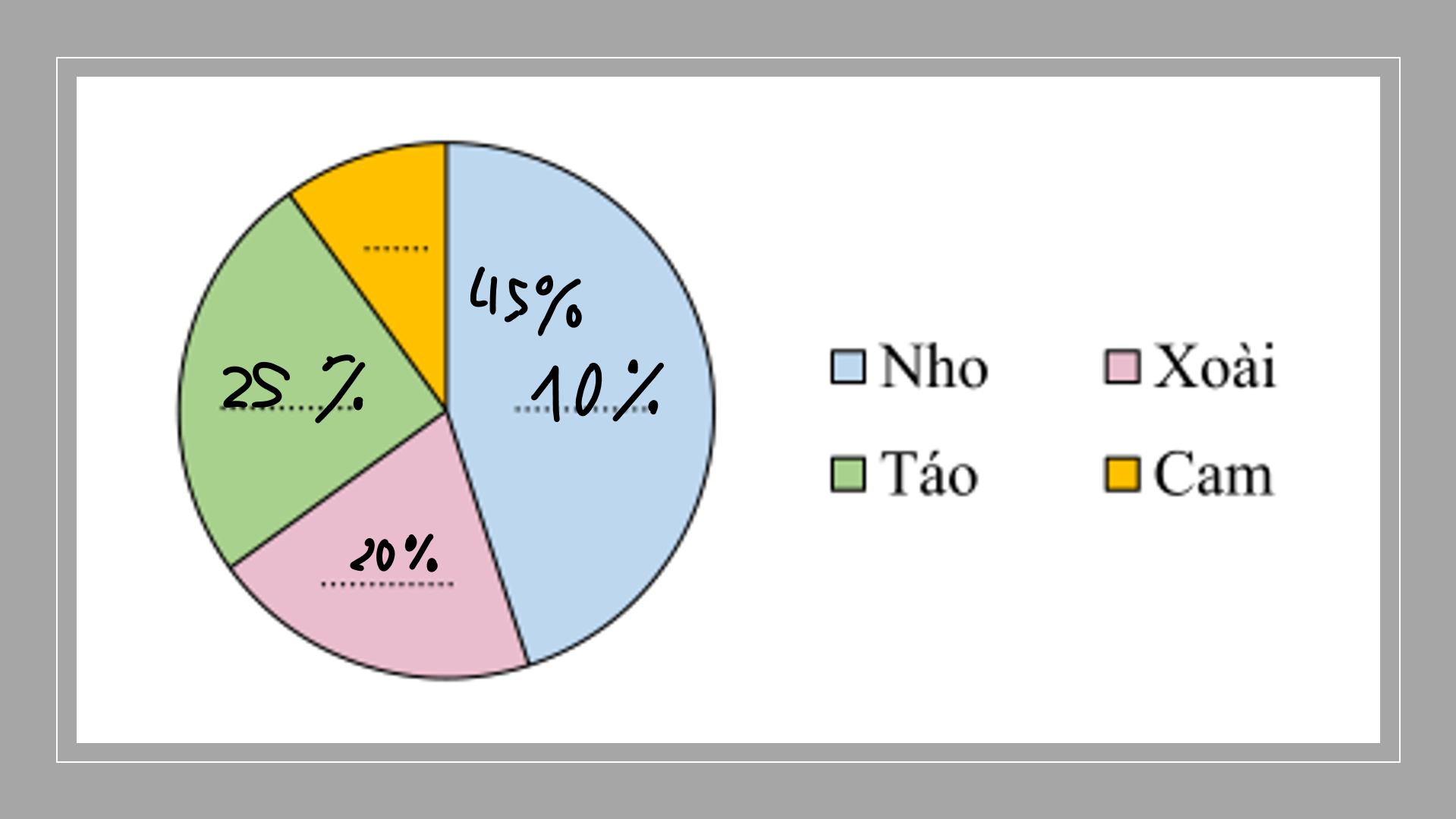
Vậy vận tốc của Trang là khoảng 1,71 km/h.
vận tôc của trang là 1,71 km/h