Bài 1 hãy chọn cụm từ thích hợp điền vào chỗ trống các câu sau a) động vật cây cối sông suối ao hồ là những ........ sách vở ti vi bàn học xe máy qoạt điện là những ...........
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


`a.` \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,1 ( mol )
\(Fe_xO_y+2yHCl\rightarrow xFeCl_{\dfrac{2y}{x}}+yH_2O\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Fe_xO_y}=6,4-5,6=0,8\left(g\right)\)
Ta có: 3,2g hh + H2 `->` 0,1g H2O
\(\Rightarrow\) 6,4g hh + H2 `->` 0,2g H2O
\(n_{H_2O}=\dfrac{0,2}{18}=\dfrac{1}{90}\left(mol\right)\)
\(Fe_xO_y+yH_2\rightarrow\left(t^o\right)xFe+yH_2O\)
\(\Rightarrow n_{O\left(Fe_xO_y\right)}=n_{H_2O}=\dfrac{1}{90}\left(mol\right)\)
Ta có:\(m_{Fe_xO_y}=56x+16.\dfrac{1}{90}=0,8\)
\(\Leftrightarrow x=\dfrac{1}{90}\)
\(\Rightarrow x:y=\dfrac{1}{90}:\dfrac{1}{90}=1:1\)
\(\Rightarrow CTHH:FeO\)

Ta có: \(\left\{{}\begin{matrix}p+e+n=58\\p=e\\p+e-n=18\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=19\\n=20\end{matrix}\right.\)

Gọi \(n_{CuSO_4}=n_{CaCO_3}=a\left(mol\right)\)
`=> 160a + 100a = 52`
`=> a = 0,2 (mol) = n_{CuSO_4} + n_{CaCO_3}`

| Danh sách nguyên tố hóa học | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Z | Ký hiệu | Tên | Tên tiếng Anh | Nguồn gốc tên gọi[1] | Nhóm | Chu kỳ | Nguyên tử khối u () |
Khối lượng riêng g/cm³ |
Nhiệt độ nóng chảy °K |
Nhiệt độ bay hơi °K |
Nhiệt dung riêng J/g·K |
Độ âm điện10 | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 1 | H | Hiđrô | Hydrogen | tiếng Hy Lạp hydro, nghĩa là "nước" | 1 | 1 | 1,0082 3 4 9 | 0,00008988 | 14,01 | 20,28 | 14,304 | 2,20 | 1400 |
| 2 | He | Heli | Helium | tiếng Hy Lạp helios, nghĩa là "Mặt Trời" | 18 | 1 | 4,002602(2)2 4 | 0,0001785 | 0,956 | 4,22 | 5,193 | – | 0,008 |
| 3 | Li | Lithi | Lithium | tiếng Hy Lạp lithos, nghĩa là "đá" | 1 | 2 | 6,942 3 4 5 9 | 0,534 | 453,69 | 1560 | 3,582 | 0,98 | 20 |
| 4 | Be | Beryli | Berylium | tiếng Hy Lạp beryllo | 2 | 2 | 9,012182(3) | 1,85 | 1560 | 2742 | 1,825 | 1,57 | 2,8 |
| 5 | B | Bo | Boron | tiếng Ả Rập buraq - tên của hợp chất borac | 13 | 2 | 10,812 3 4 9 | 2,34 | 2349 | 4200 | 1,026 | 2,04 | 10 |
| 6 | C | Cacbon | Carbon | tiếng Latinh carbo, nghĩa là "than" | 14 | 2 | 12,0112 4 9 | 2,267 | 3800 | 4300 | 0,709 | 2,55 | 200 |
| 7 | N | Nitơ | Nitrogen | tiếng Hy Lạp nitron | 15 | 2 | 14,0072 4 9 | 0,0012506 | 63,15 | 77,36 | 1,04 | 3,04 | 19 |
| 8 | O | Oxy | Oxygen | tiếng Hy Lạp oxy, nghĩa là sinh ra acid | 16 | 2 | 15,9992 4 9 | 0,001429 | 54,36 | 90,20 | 0,918 | 3,44 | 461000 |
| 9 | F | fluor | fluorurine | tiếng Latinh fluere, nghĩa là "chảy" | 17 | 2 | 18,9984032(5) | 0,001696 | 53,53 | 85,03 | 0,824 | 3,98 | 585 |
| 10 | Ne | Neon | Neon | tiếng Hy Lạp neos, nghĩa là "mới" | 18 | 2 | 20,1797(6)2 3 | 0,0008999 | 24,56 | 27,07 | 1,03 | – | 0,005 |
| 11 | Na | Natri | Sodium (Natrium) | tiếng Latinh natrium[2] | 1 | 3 | 22,98976928(2) | 0,971 | 370,87 | 1156 | 1,228 | 0,93 | 23600 |
| 12 | Mg | Magiê | Magnesium | đặt theo tên quận Magnesia ở Đông Thessalía, Hy Lạp | 2 | 3 | 24,3059 | 1,738 | 923 | 1363 | 1,023 | 1,31 | 23300 |
| 13 | Al | Nhôm | Aluminum | aluminium là tên tiếng Latinh của phèn; alumen nghĩa là "muối đắng" | 13 | 3 | 26,9815386(8) | 2,698 | 933,47 | 2792 | 0,897 | 1,61 | 82300 |
| 14 | Si | Silic | Silicon | tiếng Latinh silex hoặc silicis, nghĩa là "đá lửa" | 14 | 3 | 28,0854 9 | 2,3296 | 1687 | 3538 | 0,705 | 1,9 | 282000 |
| 15 | P | Phosphor | Phosphorus | tiếng Hy Lạp phosphoros, nghĩa là "người mang đến ánh sáng" | 15 | 3 | 30,973762(2) | 1,82 | 317,30 | 550 | 0,769 | 2,19 | 1050 |
| 16 | S | Lưu huỳnh | Sulfur | danh từ sulfur bắt nguồn từ tiếng Phạn sulvere hoặc tiếng Latinh sulfurium; cả hai đều có nghĩa là "lưu huỳnh"[2] | 16 | 3 | 32,062 4 9 | 2,067 | 388,36 | 717,87 | 0,71 | 2,58 | 350 |
| 17 | Cl | Clo | Chlorine | tiếng Hy Lạp chloros, nghĩa là "vàng lục" | 17 | 3 | 35,452 3 4 9 | 0,003214 | 171,6 | 239,11 | 0,479 | 3,16 | 145 |
| 18 | Ar | Argon | Argon | tiếng Hy Lạp argos, nghĩa là "nhàn rỗi" | 18 | 3 | 39,948(1)2 4 | 0,0017837 | 83,80 | 87,30 | 0,52 | – | 3,5 |
| 19 | K | Kali | Potassium (Kalium) | tiếng Latinh kalium[2] | 1 | 4 | 39,0983(1) | 0,862 | 336,53 | 1032 | 0,757 | 0,82 | 20900 |
| 20 | Ca | Calci | Calcium | tiếng Latinh calx, nghĩa là vôi | 2 | 4 | 40,078(4)2 | 1,54 | 1115 | 1757 | 0,647 | 1 | 41500 |
| 21 | Sc | Scandi | Scandium | đặt theo địa danh Scandinavia (tên tiếng Latinh là Scandia) | 3 | 4 | 44,955912(6) | 2,989 | 1814 | 3109 | 0,568 | 1,36 | 22 |
| 22 | Ti | Titan | Titanium | đặt theo tên nhân vật Titan trong thần thoại Hy Lạp | 4 | 4 | 47,867(1) | 4,54 | 1941 | 3560 | 0,523 | 1,54 | 5650 |
| 23 | V | Vanadi | Vanadium | đặt theo tên gọi Vanadis - tên cũ để chỉ nữ thần Freyja trong thần thoại Bắc Âu | 5 | 4 | 50,9415(1) | 6,11 | 2183 | 3680 | 0,489 | 1,63 | 120 |
| 24 | Cr | Crom | Chromium | tiếng Hy Lạp chroma, nghĩa là "màu sắc" | 6 | 4 | 51,9961(6) | 7,15 | 2180 | 2944 | 0,449 | 1,66 | 102 |
| 25 | Mn | Mangan | Manganese | hoặc là từ tiếng Latinh magnes (nghĩa là "nam châm"), hoặc từ magnesia nigra ("oxide magiê đen") | 7 | 4 | 54,938045(5) | 7,44 | 1519 | 2334 | 0,479 | 1,55 | 950 |
| 26 | Fe | Sắt | Iron (Ferrum) | ký hiệu Fe ứng với tên tiếng Latinh ferrum | 8 | 4 | 55,845(2) | 7,874 | 1811 | 3134 | 0,449 | 1,83 | 56300 |
| 27 | Co | Coban | Cobalt | tiếng Đức, kobold, nghĩa là kim loại của quỷ. Tên này do các người thợ mỏ đặt vì chúng rất độc hại. | 9 | 4 | 58,933195(5) | 8,86 | 1768 | 3200 | 0,421 | 1,88 | 25 |
| 28 | Ni | Niken | Nikel | tiếng Đức kupfernickel, nghĩa là "kim loại đồng của quỷ" hoặc "kim loại đồng của thánh Nicôla" | 10 | 4 | 58,6934(4) | 8,912 | 1728 | 3186 | 0,444 | 1,91 | 84 |
| 29 | Cu | Đồng | Copper (cuprum) | trong tiếng Anh, đồng được gọi là copper. Đây là danh từ bắt nguồn từ tiếng Anh cổ coper, mà coper lại bắt nguồn từ tiếng Latinh Cyprium aes, nghĩa là "kim loại từ đảo Síp" | 11 | 4 | 63,546(3)4 | 8,96 | 1357,77 | 2835 | 0,385 | 1,9 | 60 |
| 30 | Zn | Kẽm | Zinc | ký hiệu Zn ứng với từ tiếng Đức zinc; từ này bắt nguồn từ tiếng Ba Tư là sing, nghĩa là "đá" | 12 | 4 | 65,38(2) | 7,134 | 692,88 | 1180 | 0,388 | 1,65 | 70 |
| 31 | Ga | Gali | Galium | tiếng Latinh Gallia, tên cổ nước Pháp | 13 | 4 | 69,723(1) | 5,907 | 302,9146 | 2477 | 0,371 | 1,81 | 19 |
| 32 | Ge | Germani | Germanium | tiếng Latinh Germania, nghĩa là "Đức" | 14 | 4 | 72,630(8) | 5,323 | 1211,40 | 3106 | 0,32 | 2,01 | 1,5 |
| 33 | As | Asen | Arsenic | tiếng Hy Lạp arsenikon, nghĩa là "orpiment nhuộm vàng" | 15 | 4 | 74,92160(2) | 5,776 | 1090 7 | 887 | 0,329 | 2,18 | 1,8 |
| 34 | Se | Seleni | Selenium | tiếng Hy Lạp selene, nghĩa là "Mặt Trăng" | 16 | 4 | 78,96(3)4 | 4,809 | 453 | 958 | 0,321 | 2,55 | 0,05 |
| 35 | Br | Brom | Bromine | tiếng Hy Lạp bromos, nghĩa là "mùi thối" | 17 | 4 | 79,9049 | 3,122 | 265,8 | 332,0 | 0,474 | 2,96 | 2,4 |
| 36 | Kr | Krypton | Krypton | tiếng Hy Lạp kryptos, nghĩa là "ẩn giấu" | 18 | 4 | 83,798(2)2 3 | 0,003733 | 115,79 | 119,93 | 0,248 | 3 | <0,001 |
| 37 | Rb | Rubiđi | Rubidium | tiếng Latinh rubidius, nghĩa là "đỏ cực kỳ sẫm" | 1 | 5 | 85,4678(3)2 | 1,532 | 312,46 | 961 | 0,363 | 0,82 | 90 |
| 38 | Sr | Stronti | Strontium | đặt theo địa danh Strontian - một thị trấn ở Scotland | 2 | 5 | 87,62(1)2 4 | 2,64 | 1050 | 1655 | 0,301 | 0,95 | 370 |
| 39 | Y | Ytri | Ytrium | đặt theo địa danh Ytterby, Thụy Điển | 3 | 5 | 88,90585(2) | 4,469 | 1799 | 3609 | 0,298 | 1,22 | 33 |
| 40 | Zr | Zirconi | Zirconium | tiếng Ba Tư zargun, nghĩa là "có màu của vàng" | 4 | 5 | 91,224(2)2 | 6,506 | 2128 | 4682 | 0,278 | 1,33 | 165 |
| 41 | Nb | Niobi | Niobium | đặt theo tên của Niobe - con gái vua Tantalus trong thần thoại Hy Lạp | 5 | 5 | 92,90638(2) | 8,57 | 2750 | 5017 | 0,265 | 1,6 | 20 |
| 42 | Mo | Molypden | Molybdenum | tiếng Hy Lạp molybdos, nghĩa là "chì" | 6 | 5 | 95,96(2)2 | 10,22 | 2896 | 4912 | 0,251 | 2,16 | 1,2 |
| 43 | Tc | Tecneti | Technetium | tiếng Hy Lạp tekhnetos, nghĩa là "nhân tạo" | 7 | 5 | [98]1 | 11,5 | 2430 | 4538 | – | 1,9 | <0,001 |
| 44 | Ru | Rutheni | Ruthenium | tiếng Latinh Ruthenia, nghĩa là "Nga" | 8 | 5 | 101,07(2)2 | 12,37 | 2607 | 4423 | 0,238 | 2,2 | 0,001 |
| 45 | Rh | Rhodi | Rhodium | tiếng Hy Lạp rhodon, nghĩa là "có màu hoa hồng" | 9 | 5 | 102,90550(2) | 12,41 | 2237 | 3968 | 0,243 | 2,28 | 0,001 |
| 46 | Pd | Paladi | Paladium | đặt theo theo tên của tiểu hành tinh 2 Pallas - có thời từng được xem là hành tinh | 10 | 5 | 106,42(1)2 | 12,02 | 1828,05 | 3236 | 0,244 | 2,2 | 0,015 |
| 47 | Ag | Bạc | Silver (Argentum) | tiếng Latinh argentum[2] | 11 | 5 | 107,8682(2)2 | 10,501 | 1234,93 | 2435 | 0,235 | 1,93 | 0,075 |
| 48 | Cd | Cadmi | Cadmium | tiếng Latinh cadmia (khoáng chất calmine) | 12 | 5 | 112,411(8)2 | 8,69 | 594,22 | 1040 | 0,232 | 1,69 | 0,159 |
| 49 | In | Indi | Indium | tiếng Latinh indicium, nghĩa là "màu tím" hoặc "màu chàm" | 13 | 5 | 114,818(1) | 7,31 | 429,75 | 2345 | 0,233 | 1,78 | 0,25 |
| 50 | Sn | Thiếc | Tin (Stannum) | ký hiệu Sn ứng với tên tiếng Latinh stannum, nghĩa là "cứng" | 14 | 5 | 118,710(7)2 | 7,287 | 505,08 | 2875 | 0,228 | 1,96 | 2,3 |
| 51 | Sb | Antimon | Antimony (Stibium) | tiếng Hy Lạp anti – monos, nghĩa là "không đơn độc" (tiếng Latinh: stibium) | 15 | 5 | 121,760(1)2 | 6,685 | 903,78 | 1860 | 0,207 | 2,05 | 0,2 |
| 52 | Te | Teluride | Tellurium | tiếng Latinh tellus, nghĩa là "Trái Đất" | 16 | 5 | 127,60(3)2 | 6,232 | 722,66 | 1261 | 0,202 | 2,1 | 0,001 |
| 53 | I | Iod | Iodine | tiếng Hy Lạp iodes, nghĩa là "màu tím" | 17 | 5 | 126,90447(3) | 4,93 | 386,85 | 457,4 | 0,214 | 2,66 | 0,45 |
| 54 | Xe | Xenon | Xenon | tiếng Hy Lạp xenos, nghĩa là "kẻ lạ" | 18 | 5 | 131,293(6)2 3 | 0,005887 | 161,4 | 165,03 | 0,158 | 2,6 | <0,001 |
| 55 | Cs | Xêzi | Caesium | tiếng Latinh caesius, nghĩa là "màu xanh da trời" | 1 | 6 | 132,9054519(2) | 1,873 | 301,59 | 944 | 0,242 | 0,79 | 3 |
| 56 | Ba | Bari | Barium | tiếng Hy Lạp barys, nghĩa là "nặng" | 2 | 6 | 137,327(7) | 3,594 | 1000 | 2170 | 0,204 | 0,89 | 425 |
| 57 | La | Lanthan | Lanthanum | tiếng Hy Lạp lanthanein, nghĩa là "nằm ẩn giấu" | 6 | 138,90547(7)2 | 6,145 | 1193 | 3737 | 0,195 | 1,1 | 39 | |
| 58 | Ce | Xeri | Cerium | đặt tên tên vị thần nông nghiệp Ceres trong thần thoại La Mã | 6 | 140,116(1)2 | 6,77 | 1068 | 3716 | 0,192 | 1,12 | 66,5 | |
| 59 | Pr | Praseodymi | Praseodymium | tiếng Hy Lạp prasios didymos, nghĩa là "cặp song sinh xanh lục" | 6 | 140,90765(2) | 6,773 | 1208 | 3793 | 0,193 | 1,13 | 9,2 | |
| 60 | Nd | Neodymi | Neodymium | tiếng Hy Lạp neos didymos, nghĩa là "cặp song sinh mới" | 6 | 144,242(3)2 | 7,007 | 1297 | 3347 | 0,19 | 1,14 | 41,5 | |
| 61 | Pm | Promethi | Promethium | đặt theo tên Prometheus trong thần thoại Hy Lạp. Prometheus là người đã đánh cắp lửa từ các thần và giao nó cho con người. | 6 | [145]1 | 7,26 | 1315 | 3273 | – | 1,13 | <0,001 | |
| 62 | Sm | Samari | Samarium | samari lần đầu tiên được cô lập là từ khoáng chất samarskite | 6 | 150,36(2)2 | 7,52 | 1345 | 2067 | 0,197 | 1,17 | 7,05 | |
| 63 | Eu | Europi | Europium | đặt theo địa danh "Châu Âu" | 6 | 151,964(1)2 | 5,243 | 1099 | 1802 | 0,182 | 1,2 | 2 | |
| 64 | Gd | Gadolini | Gadonlinium | đặt theo họ nhà hóa học, vật lý học và khoáng vật học Johan Gadolin | 6 | 157,25(3)2 | 7,895 | 1585 | 3546 | 0,236 | 1,2 | 6,2 | |
| 65 | Tb | Terbi | Terbium | đặt theo địa danh Ytterby, Thụy Điển | 6 | 158,92535(2) | 8,229 | 1629 | 3503 | 0,182 | 1,2 | 1,2 | |
| 66 | Dy | Dysprosi | Dysprosium | tiếng Hy Lạp dysprositos, nghĩa là "khó lấy được" | 6 | 162,500(1)2 | 8,55 | 1680 | 2840 | 0,17 | 1,22 | 5,2 | |
| 67 | Ho | Holmi | Holmium | tiếng Latinh Holmia, nghĩa là "Stockholm", Thụy Điển | 6 | 164,93032(2) | 8,795 | 1734 | 2993 | 0,165 | 1,23 | 1,3 | |
| 68 | Er | Erbi | Erbium | đặt theo địa danh Ytterby, Thụy Điển | 6 | 167,259(3)2 | 9,066 | 1802 | 3141 | 0,168 | 1,24 | 3,5 | |
| 69 | Tm | Thuli | Thulium | đặt theo địa danh Thule - tên cổ của Scandinavia | 6 | 168,93421(2) | 9,321 | 1818 | 2223 | 0,16 | 1,25 | 0,52 | |
| 70 | Yb | Yterbi | Yterbium | đặt theo địa danh Ytterby, Thụy Điển | 6 | 173,054(5)2 | 6,965 | 1097 | 1469 | 0,155 | 1,1 | 3,2 | |
| 71 | Lu | Luteti | Lutetium | đặt theo địa danh La Mã Lutetia, nghĩa là "Paris", Pháp | 3 | 6 | 174,9668(1)2 | 9,84 | 1925 | 3675 | 0,154 | 1,27 | 0,8 |
| 72 | Hf | Hafni | Hafnium | đặt theo địa danh trong tiếng Latinh là Hafnia, nghĩa là "Copenhagen", Đan Mạch | 4 | 6 | 178,49(2) | 13,31 | 2506 | 4876 | 0,144 | 1,3 | 3 |
| 73 | Ta | Tantali | Tantalum | đặt theo danh xưng của vua Tantalus - cha của Niobe trong thần thoại Hy Lạp | 5 | 6 | 180,94788(2) | 16,654 | 3290 | 5731 | 0,14 | 1,5 | 2 |
| 74 | W | Wolfram | Tungsten (Wolfram) | wolfram là tên cũ của khoáng chất wolframite[2] | 6 | 6 | 183,84(1) | 19,25 | 3695 | 5828 | 0,132 | 2,36 | 1,3 |
| 75 | Re | Rheni | Rhenium | tiếng Latinh Rhenia, nghĩa là sông "Rhine" - con sông chảy từ Graubünden ở đông Anpơ Thụy Sĩ ra bờ biển Bắc ở Hà Lan | 7 | 6 | 186,207(1) | 21,02 | 3459 | 5869 | 0,137 | 1,9 | <0,001 |
| 76 | Os | Osmi | Osmium | tiếng Hy Lạp osme, nghĩa là "mùi" | 8 | 6 | 190,23(3)2 | 22,61 | 3306 | 5285 | 0,13 | 2,2 | 0,002 |
| 77 | Ir | Iridi | Iridium | đặt theo tên thần Iris - nữ thần cầu vồng trong thần thoại Hy Lạp | 9 | 6 | 192,217(3) | 22,56 | 2719 | 4701 | 0,131 | 2,2 | 0,001 |
| 78 | Pt | Platin | Plantinum | tiếng Tây Ban Nha platina, nghĩa là "bạc nhỏ" | 10 | 6 | 195,084(9) | 21,46 | 2041,4 | 4098 | 0,133 | 2,28 | 0,005 |
| 79 | Au | Vàng | Gold (Aurum) | ký hiệu Au ứng với tên tiếng Latinh aurum, nghĩa là "quầng sáng của bình minh"[2] | 11 | 6 | 196,966569(4) | 19,282 | 1337,33 | 3129 | 0,129 | 2,54 | 0,004 |
| 80 | Hg | Thủy ngân | Mercury (Hydrargyrum) | ký hiệu Hg ứng với tên cũ hydrargyrum, trong đó hydr- và argyros lần lượt có nghĩa là "nước" và "bạc" (trong tiếng Hy Lạp). | 12 | 6 | 200,592(3) | 13,5336 | 234,43 | 629,88 | 0,14 | 2 | 0,085 |
| 81 | Tl | Tali | Thalium | tiếng Hy Lạp thallos, nghĩa là "nhánh cây con màu lục" | 13 | 6 | 204,389 | 11,85 | 577 | 1746 | 0,129 | 1,62 | 0,85 |
| 82 | Pb | Chì | Lead (Plumbum) | ký hiệu Pb ứng với tên tiếng Latinh plumbum[2] | 14 | 6 | 207,2(1)2 4 | 11,342 | 600,61 | 2022 | 0,129 | 1,87 | 14 |
| 83 | Bi | Bismuth | Bismuth | tiếng Đức 'Bisemutum'; đây vốn là cách viết sai của cụm từ Weisse Masse, nghĩa là "vật chất trắng" | 15 | 6 | 208,98040(1)1 | 9,807 | 544,7 | 1837 | 0,122 | 2,02 | 0,009 |
| 84 | Po | Poloni | Polonium | tiếng Latinh Polonia, nghĩa là "Ba Lan" - quê quán của Marie Curie, người đầu tiên cô lập nguyên tố này | 16 | 6 | [209]1 | 9,32 | 527 | 1235 | – | 2,0 | <0,001 |
| 85 | At | Astatin | Astatine | tiếng Hy Lạp astatos, nghĩa là "không ổn định" | 17 | 6 | [210]1 | 7 | 575 | 610 | – | 2,2 | <0,001 |
| 86 | Rn | Radon | Radon | đặt theo tên của nguyên tố radi, bởi vì đầu tiên radon được phát hiện khi nó thoát ra từ radi trong quá trình phân rã phóng xạ | 18 | 6 | [222]1 | 0,00973 | 202 | 211,3 | 0,094 | 2,2 | <0,001 |
| 87 | Fr | Franci | Francium | nghĩa là "Pháp" - nơi lần đầu tiên phát hiện ra nguyên tố này | 1 | 7 | [223]1 | 1,87 | 300 | 950 | – | 0,7 | <0,001 |
| 88 | Ra | Radi | Radium | tiếng Latinh radius, nghĩa là "tia" | 2 | 7 | [226]1 | 5,5 | 973 | 2010 | 0,094 | 0,9 | <0,001 |
| 89 | Ac | Actini | Actinium | tiếng Hy Lạp actinos, nghĩa là "một tia" | 7 | [227]1 | 10,07 | 1323 | 3471 | 0,12 | 1,1 | <0,001 | |
| 90 | Th | Thori | Thorium | đặt theo tên thần sấm Thor trong thần thoại Scandinavia | 7 | 232,03806(2)1 2 | 11,72 | 2115 | 5061 | 0,113 | 1,3 | 9,6 | |
| 91 | Pa | Protactini | Protactinium | tiền tố protos trong tiếng Hy Lạp có nghĩa là "đầu tiên", bởi lẽ actini được tạo ra thông qua quá trình phân rã phóng xạ của protactini | 7 | 231,03588(2)1 | 15,37 | 1841 | 4300 | – | 1,5 | <0,001 | |
| 92 | U | Urani | Uranium | nghĩa là "sao Thiên Vương" | 7 | 238,02891(3)1 | 18,95 | 1405,3 | 4404 | 0,116 | 1,38 | 2,7 | |
| 93 | Np | Neptuni | Neptunium | nghĩa là "sao Hải Vương" | 7 | [237]1 | 20,45 | 917 | 4273 | – | 1,36 | <0,001 | |
| 94 | Pu | Plutoni | Plutonium | nghĩa là "sao Diêm Vương" | 7 | [244]1 | 19,84 | 912,5 | 3501 | – | 1,28 | <0,001 | |
| 95 | Am | Americi | Americium | nghĩa là "châu Mỹ" | 7 | [243]1 | 13,69 | 1449 | 2880 | – | 1,13 | <0,001 | |
| 96 | Cm | Curi | Curium | đặt theo họ của nhà vật lý học Pierre Curie và nhà vật lý học - hóa học Marie Curie | 7 | [247]1 | 13,51 | 1613 | 3383 | – | 1,28 | <0,001 | |
| 97 | Bk | Berkeli | Berkelium | đặt theo địa danh Berkeley, California, Hoa Kỳ - nơi lần đầu tiên tổng hợp nguyên tố này | 7 | [247]1 | 14,79 | 1259 | 2900 | – | 1,3 | <0,001 | |
| 98 | Cf | Californi | Californium | đặt theo địa danh California, Hoa Kỳ - nơi lần đầu tiên tổng hợp nguyên tố này | 7 | [251]1 | 15,1 | 1173 | (1743)11 | – | 1,3 | <0,001 | |
| 99 | Es | Einsteini | Einsteinium | đặt theo họ của nhà vật lý học Albert Einstein | 7 | [252]1 | 8,84 | 1133 | (1269)11 | – | 1,3 | 0 8 | |
| 100 | Fm | Fermi | Fermium | đặt theo họ của nhà vật lý học Enrico Fermi | 7 | [257]1 | – | (1800)11 | – | – | 1,3 | 0 8 | |
| 101 | Md | Mendelevi | Mendelevium | đặt theo họ của nhà hóa học và nhà phát minh Dmitri Ivanovich Mendeleev | 7 | [258]1 | – | (1100)11 | – | – | 1,3 | 0 8 | |
| 102 | No | Nobeli | Nobelium | đặt theo họ của nhà hóa học, kỹ sư, nhà phát minh, nhà sản xuất vũ khí Alfred Nobel | 7 | [259]1 | – | (1100)11 | – | – | 1,3 | 0 8 | |
| 103 | Lr | Lawrenci | Lawrencium | đặt theo họ của nhà vật lý học Ernest Lawrence | 3 | 7 | [262]1 | – | (1900)11 | – | – | 1,3 | 0 8 |
| 104 | Rf | Rutherfordi | Rutherfordium | đặt theo họ của nhà vật lý học - hóa học Ernest Rutherford | 4 | 7 | [267]1 | (23,2)11 | (2400)11 | (5800)11 | – | – | 0 8 |
| 105 | Db | Dubni | Dubnium | đặt theo địa danh Dubna, Nga | 5 | 7 | [268]1 | (29,3)11 | – | – | – | – | 0 8 |
| 106 | Sg | Seaborgi | Seaborgium | đặt theo họ của nhà khoa học Glenn Seaborg | 6 | 7 | [269]1 | (35,0)11 | – | – | – | – | 0 8 |
| 107 | Bh | Bohri | Bohrium | đặt theo họ của nhà vật lý học Niels Bohr | 7 | 7 | [270]1 | (37,1)11 | – | – | – | – | 0 8 |
| 108 | Hs | Hassi | Hassium | đặt theo địa danh Hessen, Đức - nơi đầu tiên tổng hợp nguyên tố này | 8 | 7 | [269]1 | (40,7)11 | – | – | – | – | 0 8 |
| 109 | Mt | Meitneri | Meitnerium | đặt theo họ của nhà vật lý học Lise Meitner | 9 | 7 | [278]1 | (37,4)11 | – | – | – | – | 0 8 |
| 110 | Ds | Darmstadti | Darmstadtium | đặt theo địa danh Darmstadt, Đức - nơi đầu tiên tổng hợp nguyên tố này | 10 | 7 | [281]1 | (34,8)11 | – | – | – | – | 0 8 |
| 111 | Rg | Roentgeni | Roentgenium | đặt theo họ của nhà vật lý học Wilhelm Röntgen | 11 | 7 | [281]1 | (28,7)11 | – | – | – | – | 0 8 |
| 112 | Cn | Copernixi | Copernicium | đặt theo họ của nhà thiên văn học Nicolaus Copernicus | 12 | 7 | [285]1 | (23,7)11 | – | 357 12 | – | – | 0 8 |
| 113 | Nh | Nihoni | Nihonium | tiếng Nhật nihon nghĩa là Nhật Bản - nơi đầu tiên tổng hợp nguyên tố này | 13 | 7 | [286]1 | (16)11 | (700)11 | (1400)11 | – | – | 0 8 |
| 114 | Fl | Flerovi | Flerovium | đặt theo họ của nhà vật lý học Georgy Flyorov | 14 | 7 | [289]1 | (14)11 | (340)11 | (420)11 | – | – | 0 8 |
| 115 | Mc | Moscovi | Moscovium | Moskva, Nga - nơi đầu tiên tổng hợp nguyên tố này | 15 | 7 | [288]1 | (13,5)11 | (700)11 | (1400)11 | – | – | 0 8 |
| 116 | Lv | Livermori | Livermorium | đặt theo tên Phòng thí nghiệm Quốc gia Lawrence Livermore (ở Livermore, California) - đơn vị đã hợp tác cùng Viện Liên hợp Nghiên cứu Hạt nhân tổng hợp ra nguyên tố này | 16 | 7 | [293]1 | (12,9)11 | (708,5)11 | (1085)11 | – | – | 0 8 |
| 117 | Ts | Tennessine | Tennessine | Tennessee, Hoa Kỳ | 17 | 7 | [294]1 | (7,2)11 | (673)11 | (823)11 | – | – | 0 8 |
| 118 | Og | Oganesson | Oganesson | đặt theo họ của nhà vật lý học Yuri Oganessian | 18 | 7 | [294]1 | (5,0)11 13 | (258)11 | (263)11 | – | – | 0 8 |
| Danh sách nguyên tố hóa học | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Z | Ký hiệu | Tên | Tên tiếng Anh | Nguồn gốc tên gọi[1] | Nhóm | Chu kỳ | Nguyên tử khối u () |
Khối lượng riêng g/cm³ |
Nhiệt độ nóng chảy °K |
Nhiệt độ bay hơi °K |
Nhiệt dung riêng J/g·K |
Độ âm điện10 | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 1 | H | Hiđrô | Hydrogen | tiếng Hy Lạp hydro, nghĩa là "nước" | 1 | 1 | 1,0082 3 4 9 | 0,00008988 | 14,01 | 20,28 | 14,304 | 2,20 | 1400 |
| 2 | He | Heli | Helium | tiếng Hy Lạp helios, nghĩa là "Mặt Trời" | 18 | 1 | 4,002602(2)2 4 | 0,0001785 | 0,956 | 4,22 | 5,193 | – | 0,008 |
| 3 | Li | Lithi | Lithium | tiếng Hy Lạp lithos, nghĩa là "đá" | 1 | 2 | 6,942 3 4 5 9 | 0,534 | 453,69 | 1560 | 3,582 | 0,98 | 20 |
| 4 | Be | Beryli | Berylium | tiếng Hy Lạp beryllo | 2 | 2 | 9,012182(3) | 1,85 | 1560 | 2742 | 1,825 | 1,57 | 2,8 |
| 5 | B | Bo | Boron | tiếng Ả Rập buraq - tên của hợp chất borac | 13 | 2 | 10,812 3 4 9 | 2,34 | 2349 | 4200 | 1,026 | 2,04 | 10 |
| 6 | C | Cacbon | Carbon | tiếng Latinh carbo, nghĩa là "than" | 14 | 2 | 12,0112 4 9 | 2,267 | 3800 | 4300 | 0,709 | 2,55 | 200 |
| 7 | N | Nitơ | Nitrogen | tiếng Hy Lạp nitron | 15 | 2 | 14,0072 4 9 | 0,0012506 | 63,15 | 77,36 | 1,04 | 3,04 | 19 |
| 8 | O | Oxy | Oxygen | tiếng Hy Lạp oxy, nghĩa là sinh ra acid | 16 | 2 | 15,9992 4 9 | 0,001429 | 54,36 | 90,20 | 0,918 | 3,44 | 461000 |
| 9 | F | fluor | fluorurine | tiếng Latinh fluere, nghĩa là "chảy" | 17 | 2 | 18,9984032(5) | 0,001696 | 53,53 | 85,03 | 0,824 | 3,98 | 585 |
| 10 | Ne | Neon | Neon | tiếng Hy Lạp neos, nghĩa là "mới" | 18 | 2 | 20,1797(6)2 3 | 0,0008999 | 24,56 | 27,07 | 1,03 | – | 0,005 |
| 11 | Na | Natri | Sodium (Natrium) | tiếng Latinh natrium[2] | 1 | 3 | 22,98976928(2) | 0,971 | 370,87 | 1156 | 1,228 | 0,93 | 23600 |
| 12 | Mg | Magiê | Magnesium | đặt theo tên quận Magnesia ở Đông Thessalía, Hy Lạp | 2 | 3 | 24,3059 | 1,738 | 923 | 1363 | 1,023 | 1,31 | 23300 |
| 13 | Al | Nhôm | Aluminum | aluminium là tên tiếng Latinh của phèn; alumen nghĩa là "muối đắng" | 13 | 3 | 26,9815386(8) | 2,698 | 933,47 | 2792 | 0,897 | 1,61 | 82300 |
| 14 | Si | Silic | Silicon | tiếng Latinh silex hoặc silicis, nghĩa là "đá lửa" | 14 | 3 | 28,0854 9 | 2,3296 | 1687 | 3538 | 0,705 | 1,9 | 282000 |
| 15 | P | Phosphor | Phosphorus | tiếng Hy Lạp phosphoros, nghĩa là "người mang đến ánh sáng" | 15 | 3 | 30,973762(2) | 1,82 | 317,30 | 550 | 0,769 | 2,19 | 1050 |
| 16 | S | Lưu huỳnh | Sulfur | danh từ sulfur bắt nguồn từ tiếng Phạn sulvere hoặc tiếng Latinh sulfurium; cả hai đều có nghĩa là "lưu huỳnh"[2] | 16 | 3 | 32,062 4 9 | 2,067 | 388,36 | 717,87 | 0,71 | 2,58 | 350 |
| 17 | Cl | Clo | Chlorine | tiếng Hy Lạp chloros, nghĩa là "vàng lục" | 17 | 3 | 35,452 3 4 9 | 0,003214 | 171,6 | 239,11 | 0,479 | 3,16 | 145 |
| 18 | Ar | Argon | Argon | tiếng Hy Lạp argos, nghĩa là "nhàn rỗi" | 18 | 3 | 39,948(1)2 4 | 0,0017837 | 83,80 | 87,30 | 0,52 | – | 3,5 |
| 19 | K | Kali | Potassium (Kalium) | tiếng Latinh kalium[2] | 1 | 4 | 39,0983(1) | 0,862 | 336,53 | 1032 | 0,757 | 0,82 | 20900 |
| 20 | Ca | Calci | Calcium | tiếng Latinh calx, nghĩa là vôi | 2 | 4 | 40,078(4)2 | 1,54 | 1115 | 1757 | 0,647 | 1 | 41500 |
| 21 | Sc | Scandi | Scandium | đặt theo địa danh Scandinavia (tên tiếng Latinh là Scandia) | 3 | 4 | 44,955912(6) | 2,989 | 1814 | 3109 | 0,568 | 1,36 | 22 |
| 22 | Ti | Titan | Titanium | đặt theo tên nhân vật Titan trong thần thoại Hy Lạp | 4 | 4 | 47,867(1) | 4,54 | 1941 | 3560 | 0,523 | 1,54 | 5650 |
| 23 | V | Vanadi | Vanadium | đặt theo tên gọi Vanadis - tên cũ để chỉ nữ thần Freyja trong thần thoại Bắc Âu | 5 | 4 | 50,9415(1) | 6,11 | 2183 | 3680 | 0,489 | 1,63 | 120 |
| 24 | Cr | Crom | Chromium | tiếng Hy Lạp chroma, nghĩa là "màu sắc" | 6 | 4 | 51,9961(6) | 7,15 | 2180 | 2944 | 0,449 | 1,66 | 102 |
| 25 | Mn | Mangan | Manganese | hoặc là từ tiếng Latinh magnes (nghĩa là "nam châm"), hoặc từ magnesia nigra ("oxide magiê đen") | 7 | 4 | 54,938045(5) | 7,44 | 1519 | 2334 | 0,479 | 1,55 | 950 |
| 26 | Fe | Sắt | Iron (Ferrum) | ký hiệu Fe ứng với tên tiếng Latinh ferrum | 8 | 4 | 55,845(2) | 7,874 | 1811 | 3134 | 0,449 | 1,83 | 56300 |
| 27 | Co | Coban | Cobalt | tiếng Đức, kobold, nghĩa là kim loại của quỷ. Tên này do các người thợ mỏ đặt vì chúng rất độc hại. | 9 | 4 | 58,933195(5) | 8,86 | 1768 | 3200 | 0,421 | 1,88 | 25 |
| 28 | Ni | Niken | Nikel | tiếng Đức kupfernickel, nghĩa là "kim loại đồng của quỷ" hoặc "kim loại đồng của thánh Nicôla" | 10 | 4 | 58,6934(4) | 8,912 | 1728 | 3186 | 0,444 | 1,91 | 84 |
| 29 | Cu | Đồng | Copper (cuprum) | trong tiếng Anh, đồng được gọi là copper. Đây là danh từ bắt nguồn từ tiếng Anh cổ coper, mà coper lại bắt nguồn từ tiếng Latinh Cyprium aes, nghĩa là "kim loại từ đảo Síp" | 11 | 4 | 63,546(3)4 | 8,96 | 1357,77 | 2835 | 0,385 | 1,9 | 60 |
| 30 | Zn | Kẽm | Zinc | ký hiệu Zn ứng với từ tiếng Đức zinc; từ này bắt nguồn từ tiếng Ba Tư là sing, nghĩa là "đá" | 12 | 4 | 65,38(2) | 7,134 | 692,88 | 1180 | 0,388 | 1,65 | 70 |
| 31 | Ga | Gali | Galium | tiếng Latinh Gallia, tên cổ nước Pháp | 13 | 4 | 69,723(1) | 5,907 | 302,9146 | 2477 | 0,371 | 1,81 | 19 |
| 32 | Ge | Germani | Germanium | tiếng Latinh Germania, nghĩa là "Đức" | 14 | 4 | 72,630(8) | 5,323 | 1211,40 | 3106 | 0,32 | 2,01 | 1,5 |
| 33 | As | Asen | Arsenic | tiếng Hy Lạp arsenikon, nghĩa là "orpiment nhuộm vàng" | 15 | 4 | 74,92160(2) | 5,776 | 1090 7 | 887 | 0,329 | 2,18 | 1,8 |
| 34 | Se | Seleni | Selenium | tiếng Hy Lạp selene, nghĩa là "Mặt Trăng" | 16 | 4 | 78,96(3)4 | 4,809 | 453 | 958 | 0,321 | 2,55 | 0,05 |
| 35 | Br | Brom | Bromine | tiếng Hy Lạp bromos, nghĩa là "mùi thối" | 17 | 4 | 79,9049 | 3,122 | 265,8 | 332,0 | 0,474 | 2,96 | 2,4 |
| 36 | Kr | Krypton | Krypton | tiếng Hy Lạp kryptos, nghĩa là "ẩn giấu" | 18 | 4 | 83,798(2)2 3 | 0,003733 | 115,79 | 119,93 | 0,248 | 3 | <0,001 |
| 37 | Rb | Rubiđi | Rubidium | tiếng Latinh rubidius, nghĩa là "đỏ cực kỳ sẫm" | 1 | 5 | 85,4678(3)2 | 1,532 | 312,46 | 961 | 0,363 | 0,82 | 90 |
| 38 | Sr | Stronti | Strontium | đặt theo địa danh Strontian - một thị trấn ở Scotland | 2 | 5 | 87,62(1)2 4 | 2,64 | 1050 | 1655 | 0,301 | 0,95 | 370 |
| 39 | Y | Ytri | Ytrium | đặt theo địa danh Ytterby, Thụy Điển | 3 | 5 | 88,90585(2) | 4,469 | 1799 | 3609 | 0,298 | 1,22 | 33 |
| 40 | Zr | Zirconi | Zirconium | tiếng Ba Tư zargun, nghĩa là "có màu của vàng" | 4 | 5 | 91,224(2)2 | 6,506 | 2128 | 4682 | 0,278 | 1,33 | 165 |
| 41 | Nb | Niobi | Niobium | đặt theo tên của Niobe - con gái vua Tantalus trong thần thoại Hy Lạp | 5 | 5 | 92,90638(2) | 8,57 | 2750 | 5017 | 0,265 | 1,6 | 20 |
| 42 | Mo | Molypden | Molybdenum | tiếng Hy Lạp molybdos, nghĩa là "chì" | 6 | 5 | 95,96(2)2 | 10,22 | 2896 | 4912 | 0,251 | 2,16 | 1,2 |
| 43 | Tc | Tecneti | Technetium | tiếng Hy Lạp tekhnetos, nghĩa là "nhân tạo" | 7 | 5 | [98]1 | 11,5 | 2430 | 4538 | – | 1,9 | <0,001 |
| 44 | Ru | Rutheni | Ruthenium | tiếng Latinh Ruthenia, nghĩa là "Nga" | 8 | 5 | 101,07(2)2 | 12,37 | 2607 | 4423 | 0,238 | 2,2 | 0,001 |
| 45 | Rh | Rhodi | Rhodium | tiếng Hy Lạp rhodon, nghĩa là "có màu hoa hồng" | 9 | 5 | 102,90550(2) | 12,41 | 2237 | 3968 | 0,243 | 2,28 | 0,001 |
| 46 | Pd | Paladi | Paladium | đặt theo theo tên của tiểu hành tinh 2 Pallas - có thời từng được xem là hành tinh | 10 | 5 | 106,42(1)2 | 12,02 | 1828,05 | 3236 | 0,244 | 2,2 | 0,015 |
| 47 | Ag | Bạc | Silver (Argentum) | tiếng Latinh argentum[2] | 11 | 5 | 107,8682(2)2 | 10,501 | 1234,93 | 2435 | 0,235 | 1,93 | 0,075 |
| 48 | Cd | Cadmi | Cadmium | tiếng Latinh cadmia (khoáng chất calmine) | 12 | 5 | 112,411(8)2 | 8,69 | 594,22 | 1040 | 0,232 | 1,69 | 0,159 |
| 49 | In | Indi | Indium | tiếng Latinh indicium, nghĩa là "màu tím" hoặc "màu chàm" | 13 | 5 | 114,818(1) | 7,31 | 429,75 | 2345 | 0,233 | 1,78 | 0,25 |
| 50 | Sn | Thiếc | Tin (Stannum) | ký hiệu Sn ứng với tên tiếng Latinh stannum, nghĩa là "cứng" | 14 | 5 | 118,710(7)2 | 7,287 | 505,08 | 2875 | 0,228 | 1,96 | 2,3 |
| 51 | Sb | Antimon | Antimony (Stibium) | tiếng Hy Lạp anti – monos, nghĩa là "không đơn độc" (tiếng Latinh: stibium) | 15 | 5 | 121,760(1)2 | 6,685 | 903,78 | 1860 | 0,207 | 2,05 | 0,2 |
| 52 | Te | Teluride | Tellurium | tiếng Latinh tellus, nghĩa là "Trái Đất" | 16 | 5 | 127,60(3)2 | 6,232 | 722,66 | 1261 | 0,202 | 2,1 | 0,001 |
| 53 | I | Iod | Iodine | tiếng Hy Lạp iodes, nghĩa là "màu tím" | 17 | 5 | 126,90447(3) | 4,93 | 386,85 | 457,4 | 0,214 | 2,66 | 0,45 |
| 54 | Xe | Xenon | Xenon | tiếng Hy Lạp xenos, nghĩa là "kẻ lạ" | 18 | 5 | 131,293(6)2 3 | 0,005887 | 161,4 | 165,03 | 0,158 | 2,6 | <0,001 |
| 55 | Cs | Xêzi | Caesium | tiếng Latinh caesius, nghĩa là "màu xanh da trời" | 1 | 6 | 132,9054519(2) | 1,873 | 301,59 | 944 | 0,242 | 0,79 | 3 |
| 56 | Ba | Bari | Barium | tiếng Hy Lạp barys, nghĩa là "nặng" | 2 | 6 | 137,327(7) | 3,594 | 1000 | 2170 | 0,204 | 0,89 | 425 |
| 57 | La | Lanthan | Lanthanum | tiếng Hy Lạp lanthanein, nghĩa là "nằm ẩn giấu" | 6 | 138,90547(7)2 | 6,145 | 1193 | 3737 | 0,195 | 1,1 | 39 | |
| 58 | Ce | Xeri | Cerium | đặt tên tên vị thần nông nghiệp Ceres trong thần thoại La Mã | 6 | 140,116(1)2 | 6,77 | 1068 | 3716 | 0,192 | 1,12 | 66,5 | |
| 59 | Pr | Praseodymi | Praseodymium | tiếng Hy Lạp prasios didymos, nghĩa là "cặp song sinh xanh lục" | 6 | 140,90765(2) | 6,773 | 1208 | 3793 | 0,193 | 1,13 | 9,2 | |
| 60 | Nd | Neodymi | Neodymium | tiếng Hy Lạp neos didymos, nghĩa là "cặp song sinh mới" | 6 | 144,242(3)2 | 7,007 | 1297 | 3347 | 0,19 | 1,14 | 41,5 | |
| 61 | Pm | Promethi | Promethium | đặt theo tên Prometheus trong thần thoại Hy Lạp. Prometheus là người đã đánh cắp lửa từ các thần và giao nó cho con người. | 6 | [145]1 | 7,26 | 1315 | 3273 | – | 1,13 | <0,001 | |
| 62 | Sm | Samari | Samarium | samari lần đầu tiên được cô lập là từ khoáng chất samarskite | 6 | 150,36(2)2 | 7,52 | 1345 | 2067 | 0,197 | 1,17 | 7,05 | |
| 63 | Eu | Europi | Europium | đặt theo địa danh "Châu Âu" | 6 | 151,964(1)2 | 5,243 | 1099 | 1802 | 0,182 | 1,2 | 2 | |
| 64 | Gd | Gadolini | Gadonlinium | đặt theo họ nhà hóa học, vật lý học và khoáng vật học Johan Gadolin | 6 | 157,25(3)2 | 7,895 | 1585 | 3546 | 0,236 | 1,2 | 6,2 | |
| 65 | Tb | Terbi | Terbium | đặt theo địa danh Ytterby, Thụy Điển | 6 | 158,92535(2) | 8,229 | 1629 | 3503 | 0,182 | 1,2 | 1,2 | |
| 66 | Dy | Dysprosi | Dysprosium | tiếng Hy Lạp dysprositos, nghĩa là "khó lấy được" | 6 | 162,500(1)2 | 8,55 | 1680 | 2840 | 0,17 | 1,22 | 5,2 | |
| 67 | Ho | Holmi | Holmium | tiếng Latinh Holmia, nghĩa là "Stockholm", Thụy Điển | 6 | 164,93032(2) | 8,795 | 1734 | 2993 | 0,165 | 1,23 | 1,3 | |
| 68 | Er | Erbi | Erbium | đặt theo địa danh Ytterby, Thụy Điển | 6 | 167,259(3)2 | 9,066 | 1802 | 3141 | 0,168 | 1,24 | 3,5 | |
| 69 | Tm | Thuli | Thulium | đặt theo địa danh Thule - tên cổ của Scandinavia | 6 | 168,93421(2) | 9,321 | 1818 | 2223 | 0,16 | 1,25 | 0,52 | |
| 70 | Yb | Yterbi | Yterbium | đặt theo địa danh Ytterby, Thụy Điển | 6 | 173,054(5)2 | 6,965 | 1097 | 1469 | 0,155 | 1,1 | 3,2 | |
| 71 | Lu | Luteti | Lutetium | đặt theo địa danh La Mã Lutetia, nghĩa là "Paris", Pháp | 3 | 6 | 174,9668(1)2 | 9,84 | 1925 | 3675 | 0,154 | 1,27 | 0,8 |
| 72 | Hf | Hafni | Hafnium | đặt theo địa danh trong tiếng Latinh là Hafnia, nghĩa là "Copenhagen", Đan Mạch | 4 | 6 | 178,49(2) | 13,31 | 2506 | 4876 | 0,144 | 1,3 | 3 |
| 73 | Ta | Tantali | Tantalum | đặt theo danh xưng của vua Tantalus - cha của Niobe trong thần thoại Hy Lạp | 5 | 6 | 180,94788(2) | 16,654 | 3290 | 5731 | 0,14 | 1,5 | 2 |
| 74 | W | Wolfram | Tungsten (Wolfram) | wolfram là tên cũ của khoáng chất wolframite[2] | 6 | 6 | 183,84(1) | 19,25 | 3695 | 5828 | 0,132 | 2,36 | 1,3 |
| 75 | Re | Rheni | Rhenium | tiếng Latinh Rhenia, nghĩa là sông "Rhine" - con sông chảy từ Graubünden ở đông Anpơ Thụy Sĩ ra bờ biển Bắc ở Hà Lan | 7 | 6 | 186,207(1) | 21,02 | 3459 | 5869 | 0,137 | 1,9 | <0,001 |
| 76 | Os | Osmi | Osmium | tiếng Hy Lạp osme, nghĩa là "mùi" | 8 | 6 | 190,23(3)2 | 22,61 | 3306 | 5285 | 0,13 | 2,2 | 0,002 |
| 77 | Ir | Iridi | Iridium | đặt theo tên thần Iris - nữ thần cầu vồng trong thần thoại Hy Lạp | 9 | 6 | 192,217(3) | 22,56 | 2719 | 4701 | 0,131 | 2,2 | 0,001 |
| 78 | Pt | Platin | Plantinum | tiếng Tây Ban Nha platina, nghĩa là "bạc nhỏ" | 10 | 6 | 195,084(9) | 21,46 | 2041,4 | 4098 | 0,133 | 2,28 | 0,005 |
| 79 | Au | Vàng | Gold (Aurum) | ký hiệu Au ứng với tên tiếng Latinh aurum, nghĩa là "quầng sáng của bình minh"[2] | 11 | 6 | 196,966569(4) | 19,282 | 1337,33 | 3129 | 0,129 | 2,54 | 0,004 |
| 80 | Hg | Thủy ngân | Mercury (Hydrargyrum) | ký hiệu Hg ứng với tên cũ hydrargyrum, trong đó hydr- và argyros lần lượt có nghĩa là "nước" và "bạc" (trong tiếng Hy Lạp). | 12 | 6 | 200,592(3) | 13,5336 | 234,43 | 629,88 | 0,14 | 2 | 0,085 |
| 81 | Tl | Tali | Thalium | tiếng Hy Lạp thallos, nghĩa là "nhánh cây con màu lục" | 13 | 6 | 204,389 | 11,85 | 577 | 1746 | 0,129 | 1,62 | 0,85 |
| 82 | Pb | Chì | Lead (Plumbum) | ký hiệu Pb ứng với tên tiếng Latinh plumbum[2] | 14 | 6 | 207,2(1)2 4 | 11,342 | 600,61 | 2022 | 0,129 | 1,87 | 14 |
| 83 | Bi | Bismuth | Bismuth | tiếng Đức 'Bisemutum'; đây vốn là cách viết sai của cụm từ Weisse Masse, nghĩa là "vật chất trắng" | 15 | 6 | 208,98040(1)1 | 9,807 | 544,7 | 1837 | 0,122 | 2,02 | 0,009 |
| 84 | Po | Poloni | Polonium | tiếng Latinh Polonia, nghĩa là "Ba Lan" - quê quán của Marie Curie, người đầu tiên cô lập nguyên tố này | 16 | 6 | [209]1 | 9,32 | 527 | 1235 | – | 2,0 | <0,001 |
| 85 | At | Astatin | Astatine | tiếng Hy Lạp astatos, nghĩa là "không ổn định" | 17 | 6 | [210]1 | 7 | 575 | 610 | – | 2,2 | <0,001 |
| 86 | Rn | Radon | Radon | đặt theo tên của nguyên tố radi, bởi vì đầu tiên radon được phát hiện khi nó thoát ra từ radi trong quá trình phân rã phóng xạ | 18 | 6 | [222]1 | 0,00973 | 202 | 211,3 | 0,094 | 2,2 | <0,001 |
| 87 | Fr | Franci | Francium | nghĩa là "Pháp" - nơi lần đầu tiên phát hiện ra nguyên tố này | 1 | 7 | [223]1 | 1,87 | 300 | 950 | – | 0,7 | <0,001 |
| 88 | Ra | Radi | Radium | tiếng Latinh radius, nghĩa là "tia" | 2 | 7 | [226]1 | 5,5 | 973 | 2010 | 0,094 | 0,9 | <0,001 |
| 89 | Ac | Actini | Actinium | tiếng Hy Lạp actinos, nghĩa là "một tia" | 7 | [227]1 | 10,07 | 1323 | 3471 | 0,12 | 1,1 | <0,001 | |
| 90 | Th | Thori | Thorium | đặt theo tên thần sấm Thor trong thần thoại Scandinavia | 7 | 232,03806(2)1 2 | 11,72 | 2115 | 5061 | 0,113 | 1,3 | 9,6 | |
| 91 | Pa | Protactini | Protactinium | tiền tố protos trong tiếng Hy Lạp có nghĩa là "đầu tiên", bởi lẽ actini được tạo ra thông qua quá trình phân rã phóng xạ của protactini | 7 | 231,03588(2)1 | 15,37 | 1841 | 4300 | – | 1,5 | <0,001 | |
| 92 | U | Urani | Uranium | nghĩa là "sao Thiên Vương" | 7 | 238,02891(3)1 | 18,95 | 1405,3 | 4404 | 0,116 | 1,38 | 2,7 | |
| 93 | Np | Neptuni | Neptunium | nghĩa là "sao Hải Vương" | 7 | [237]1 | 20,45 | 917 | 4273 | – | 1,36 | <0,001 | |
| 94 | Pu | Plutoni | Plutonium | nghĩa là "sao Diêm Vương" | 7 | [244]1 | 19,84 | 912,5 | 3501 | – | 1,28 | <0,001 | |
| 95 | Am | Americi | Americium | nghĩa là "châu Mỹ" | 7 | [243]1 | 13,69 | 1449 | 2880 | – | 1,13 | <0,001 | |
| 96 | Cm | Curi | Curium | đặt theo họ của nhà vật lý học Pierre Curie và nhà vật lý học - hóa học Marie Curie | 7 | [247]1 | 13,51 | 1613 | 3383 | – | 1,28 | <0,001 | |
| 97 | Bk | Berkeli | Berkelium | đặt theo địa danh Berkeley, California, Hoa Kỳ - nơi lần đầu tiên tổng hợp nguyên tố này | 7 | [247]1 | 14,79 | 1259 | 2900 | – | 1,3 | <0,001 | |
| 98 | Cf | Californi | Californium | đặt theo địa danh California, Hoa Kỳ - nơi lần đầu tiên tổng hợp nguyên tố này | 7 | [251]1 | 15,1 | 1173 | (1743)11 | – | 1,3 | <0,001 | |
| 99 | Es | Einsteini | Einsteinium | đặt theo họ của nhà vật lý học Albert Einstein | 7 | [252]1 | 8,84 | 1133 | (1269)11 | – | 1,3 | 0 8 | |
| 100 | Fm | Fermi | Fermium | đặt theo họ của nhà vật lý học Enrico Fermi | 7 | [257]1 | – | (1800)11 | – | – | 1,3 | 0 8 | |
| 101 | Md | Mendelevi | Mendelevium | đặt theo họ của nhà hóa học và nhà phát minh Dmitri Ivanovich Mendeleev | 7 | [258]1 | – | (1100)11 | – | – | 1,3 | 0 8 | |
| 102 | No | Nobeli | Nobelium | đặt theo họ của nhà hóa học, kỹ sư, nhà phát minh, nhà sản xuất vũ khí Alfred Nobel | 7 | [259]1 | – | (1100)11 | – | – | 1,3 | 0 8 | |
| 103 | Lr | Lawrenci | Lawrencium | đặt theo họ của nhà vật lý học Ernest Lawrence | 3 | 7 | [262]1 | – | (1900)11 | – | – | 1,3 | 0 8 |
| 104 | Rf | Rutherfordi | Rutherfordium | đặt theo họ của nhà vật lý học - hóa học Ernest Rutherford | 4 | 7 | [267]1 | (23,2)11 | (2400)11 | (5800)11 | – | – | 0 8 |
| 105 | Db | Dubni | Dubnium | đặt theo địa danh Dubna, Nga | 5 | 7 | [268]1 | (29,3)11 | – | – | – | – | 0 8 |
| 106 | Sg | Seaborgi | Seaborgium | đặt theo họ của nhà khoa học Glenn Seaborg | 6 | 7 | [269]1 | (35,0)11 | – | – | – | – | 0 8 |
| 107 | Bh | Bohri | Bohrium | đặt theo họ của nhà vật lý học Niels Bohr | 7 | 7 | [270]1 | (37,1)11 | – | – | – | – | 0 8 |
| 108 | Hs | Hassi | Hassium | đặt theo địa danh Hessen, Đức - nơi đầu tiên tổng hợp nguyên tố này | 8 | 7 | [269]1 | (40,7)11 | – | – | – | – | 0 8 |
| 109 | Mt | Meitneri | Meitnerium | đặt theo họ của nhà vật lý học Lise Meitner | 9 | 7 | [278]1 | (37,4)11 | – | – | – | – | 0 8 |
| 110 | Ds | Darmstadti | Darmstadtium | đặt theo địa danh Darmstadt, Đức - nơi đầu tiên tổng hợp nguyên tố này | 10 | 7 | [281]1 | (34,8)11 | – | – | – | – | 0 8 |
| 111 | Rg | Roentgeni | Roentgenium | đặt theo họ của nhà vật lý học Wilhelm Röntgen | 11 | 7 | [281]1 | (28,7)11 | – | – | – | – | 0 8 |
| 112 | Cn | Copernixi | Copernicium | đặt theo họ của nhà thiên văn học Nicolaus Copernicus | 12 | 7 | [285]1 | (23,7)11 | – | 357 12 | – | – | 0 8 |
| 113 | Nh | Nihoni | Nihonium | tiếng Nhật nihon nghĩa là Nhật Bản - nơi đầu tiên tổng hợp nguyên tố này | 13 | 7 | [286]1 | (16)11 | (700)11 | (1400)11 | – | – | 0 8 |
| 114 | Fl | Flerovi | Flerovium | đặt theo họ của nhà vật lý học Georgy Flyorov | 14 | 7 | [289]1 | (14)11 | (340)11 | (420)11 | – | – | 0 8 |
| 115 | Mc | Moscovi | Moscovium | Moskva, Nga - nơi đầu tiên tổng hợp nguyên tố này | 15 | 7 | [288]1 | (13,5)11 | (700)11 | (1400)11 | – | – | 0 8 |
| 116 | Lv | Livermori | Livermorium | đặt theo tên Phòng thí nghiệm Quốc gia Lawrence Livermore (ở Livermore, California) - đơn vị đã hợp tác cùng Viện Liên hợp Nghiên cứu Hạt nhân tổng hợp ra nguyên tố này | 16 | 7 | [293]1 | (12,9)11 | (708,5)11 | (1085)11 | – | – | 0 8 |
| 117 | Ts | Tennessine | Tennessine | Tennessee, Hoa Kỳ | 17 | 7 | [294]1 | (7,2)11 | (673)11 | (823)11 | – | – | 0 8 |
| 118 | Og | Oganesson | Oganesson | đặt theo họ của nhà vật lý học Yuri Oganessian | 18 | 7 | [294]1 | (5,0)11 13 | (258)11 | (263)11 | – | – | 0 8 |
| Danh sách nguyên tố hóa học | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Z | Ký hiệu | Tên | Tên tiếng Anh | Nguồn gốc tên gọi[1] | Nhóm | Chu kỳ | Nguyên tử khối u () |
Khối lượng riêng g/cm³ |
Nhiệt độ nóng chảy °K |
Nhiệt độ bay hơi °K |
Nhiệt dung riêng J/g·K |
Độ âm điện10 | Tỷ lệ trong vỏ Trái Đất mg/kg |
| 1 | H | Hiđrô | Hydrogen | tiếng Hy Lạp hydro, nghĩa là "nước" | 1 | 1 | 1,0082 3 4 9 | 0,00008988 | 14,01 | 20,28 | 14,304 | 2,20 | 1400 |
| 2 | He | Heli | Helium | tiếng Hy Lạp helios, nghĩa là "Mặt Trời" | 18 | 1 | 4,002602(2)2 4 | 0,0001785 | 0,956 | 4,22 | 5,193 | – | 0,008 |
| 3 | Li | Lithi | Lithium | tiếng Hy Lạp lithos, nghĩa là "đá" | 1 | 2 | 6,942 3 4 5 9 | 0,534 | 453,69 | 1560 | 3,582 | 0,98 | 20 |
| 4 | Be | Beryli | Berylium | tiếng Hy Lạp beryllo | 2 | 2 | 9,012182(3) | 1,85 | 1560 | 2742 | 1,825 | 1,57 | 2,8 |
| 5 | B | Bo | Boron | tiếng Ả Rập buraq - tên của hợp chất borac | 13 | 2 | 10,812 3 4 9 | 2,34 | 2349 | 4200 | 1,026 | 2,04 | 10 |
| 6 | C | Cacbon | Carbon | tiếng Latinh carbo, nghĩa là "than" | 14 | 2 | 12,0112 4 9 | 2,267 | 3800 | 4300 | 0,709 | 2,55 | 200 |
| 7 | N | Nitơ | Nitrogen | tiếng Hy Lạp nitron | 15 | 2 | 14,0072 4 9 | 0,0012506 | 63,15 | 77,36 | 1,04 | 3,04 | 19 |
| 8 | O | Oxy | Oxygen | tiếng Hy Lạp oxy, nghĩa là sinh ra acid | 16 | 2 | 15,9992 4 9 | 0,001429 | 54,36 | 90,20 | 0,918 | 3,44 | 461000 |
| 9 | F | fluor | fluorurine | tiếng Latinh fluere, nghĩa là "chảy" | 17 | 2 | 18,9984032(5) | 0,001696 | 53,53 | 85,03 | 0,824 | 3,98 | 585 |
| 10 | Ne | Neon | Neon | tiếng Hy Lạp neos, nghĩa là "mới" | 18 | 2 | 20,1797(6)2 3 | 0,0008999 | 24,56 | 27,07 | 1,03 | – | 0,005 |
| 11 | Na | Natri | Sodium (Natrium) | tiếng Latinh natrium[2] | 1 | 3 | 22,98976928(2) | 0,971 | 370,87 | 1156 | 1,228 | 0,93 | 23600 |
| 12 | Mg | Magiê | Magnesium | đặt theo tên quận Magnesia ở Đông Thessalía, Hy Lạp | 2 | 3 | 24,3059 | 1,738 | 923 | 1363 | 1,023 | 1,31 | 23300 |
| 13 | Al | Nhôm | Aluminum | aluminium là tên tiếng Latinh của phèn; alumen nghĩa là "muối đắng" | 13 | 3 | 26,9815386(8) | 2,698 | 933,47 | 2792 | 0,897 | 1,61 | 82300 |
| 14 | Si | Silic | Silicon | tiếng Latinh silex hoặc silicis, nghĩa là "đá lửa" | 14 | 3 | 28,0854 9 | 2,3296 | 1687 | 3538 | 0,705 | 1,9 | 282000 |
| 15 | P | Phosphor | Phosphorus | tiếng Hy Lạp phosphoros, nghĩa là "người mang đến ánh sáng" | 15 | 3 | 30,973762(2) | 1,82 | 317,30 | 550 | 0,769 | 2,19 | 1050 |
| 16 | S | Lưu huỳnh | Sulfur | danh từ sulfur bắt nguồn từ tiếng Phạn sulvere hoặc tiếng Latinh sulfurium; cả hai đều có nghĩa là "lưu huỳnh"[2] | 16 | 3 | 32,062 4 9 | 2,067 | 388,36 | 717,87 | 0,71 | 2,58 | 350 |
| 17 | Cl | Clo | Chlorine | tiếng Hy Lạp chloros, nghĩa là "vàng lục" | 17 | 3 | 35,452 3 4 9 | 0,003214 | 171,6 | 239,11 | 0,479 | 3,16 | 145 |
| 18 | Ar | Argon | Argon | tiếng Hy Lạp argos, nghĩa là "nhàn rỗi" | 18 | 3 | 39,948(1)2 4 | 0,0017837 | 83,80 | 87,30 | 0,52 | – | 3,5 |
| 19 | K | Kali | Potassium (Kalium) | tiếng Latinh kalium[2] | 1 | 4 | 39,0983(1) | 0,862 | 336,53 | 1032 | 0,757 | 0,82 | 20900 |
| 20 | Ca | Calci | Calcium | tiếng Latinh calx, nghĩa là vôi | 2 | 4 | 40,078(4)2 | 1,54 | 1115 | 1757 | 0,647 | 1 | 41500 |
| 21 | Sc | Scandi | Scandium | đặt theo địa danh Scandinavia (tên tiếng Latinh là Scandia) | 3 | 4 | 44,955912(6) | 2,989 | 1814 | 3109 | 0,568 | 1,36 | 22 |
| 22 | Ti | Titan | Titanium | đặt theo tên nhân vật Titan trong thần thoại Hy Lạp | 4 | 4 | 47,867(1) | 4,54 | 1941 | 3560 | 0,523 | 1,54 | 5650 |
| 23 | V | Vanadi | Vanadium | đặt theo tên gọi Vanadis - tên cũ để chỉ nữ thần Freyja trong thần thoại Bắc Âu | 5 | 4 | 50,9415(1) | 6,11 | 2183 | 3680 | 0,489 | 1,63 | 120 |
| 24 | Cr | Crom | Chromium | tiếng Hy Lạp chroma, nghĩa là "màu sắc" | 6 | 4 | 51,9961(6) | 7,15 | 2180 | 2944 | 0,449 | 1,66 | 102 |
| 25 | Mn | Mangan | Manganese | hoặc là từ tiếng Latinh magnes (nghĩa là "nam châm"), hoặc từ magnesia nigra ("oxide magiê đen") | 7 | 4 | 54,938045(5) | 7,44 | 1519 | 2334 | 0,479 | 1,55 | 950 |
| 26 | Fe | Sắt | Iron (Ferrum) | ký hiệu Fe ứng với tên tiếng Latinh ferrum | 8 | 4 | 55,845(2) | 7,874 | 1811 | 3134 | 0,449 | 1,83 | 56300 |
| 27 | Co | Coban | Cobalt | tiếng Đức, kobold, nghĩa là kim loại của quỷ. Tên này do các người thợ mỏ đặt vì chúng rất độc hại. | 9 | 4 | 58,933195(5) | 8,86 | 1768 | 3200 | 0,421 | 1,88 | 25 |
| 28 | Ni | Niken | Nikel | tiếng Đức kupfernickel, nghĩa là "kim loại đồng của quỷ" hoặc "kim loại đồng của thánh Nicôla" | 10 | 4 | 58,6934(4) | 8,912 | 1728 | 3186 | 0,444 | 1,91 | 84 |
| 29 | Cu | Đồng | Copper (cuprum) | trong tiếng Anh, đồng được gọi là copper. Đây là danh từ bắt nguồn từ tiếng Anh cổ coper, mà coper lại bắt nguồn từ tiếng Latinh Cyprium aes, nghĩa là "kim loại từ đảo Síp" | 11 | 4 | 63,546(3)4 | 8,96 | 1357,77 | 2835 | 0,385 | 1,9 | 60 |
| 30 | Zn | Kẽm | Zinc | ký hiệu Zn ứng với từ tiếng Đức zinc; từ này bắt nguồn từ tiếng Ba Tư là sing, nghĩa là "đá" | 12 | 4 | 65,38(2) | 7,134 | 692,88 | 1180 | 0,388 | 1,65 | 70 |
| 31 | Ga | Gali | Galium | tiếng Latinh Gallia, tên cổ nước Pháp | 13 | 4 | 69,723(1) | 5,907 | 302,9146 | 2477 | 0,371 | 1,81 | 19 |
| 32 | Ge | Germani | Germanium | tiếng Latinh Germania, nghĩa là "Đức" | 14 | 4 | 72,630(8) | 5,323 | 1211,40 | 3106 | 0,32 | 2,01 | 1,5 |
| 33 | As | Asen | Arsenic | tiếng Hy Lạp arsenikon, nghĩa là "orpiment nhuộm vàng" | 15 | 4 | 74,92160(2) | 5,776 | 1090 7 | 887 | 0,329 | 2,18 | 1,8 |
| 34 | Se | Seleni | Selenium | tiếng Hy Lạp selene, nghĩa là "Mặt Trăng" | 16 | 4 | 78,96(3)4 | 4,809 | 453 | 958 | 0,321 | 2,55 | 0,05 |
| 35 | Br | Brom | Bromine | tiếng Hy Lạp bromos, nghĩa là "mùi thối" | 17 | 4 | 79,9049 | 3,122 | 265,8 | 332,0 | 0,474 | 2,96 | 2,4 |
| 36 | Kr | Krypton | Krypton | tiếng Hy Lạp kryptos, nghĩa là "ẩn giấu" | 18 | 4 | 83,798(2)2 3 | 0,003733 | 115,79 | 119,93 | 0,248 | 3 | <0,001 |
| 37 | Rb | Rubiđi | Rubidium | tiếng Latinh rubidius, nghĩa là "đỏ cực kỳ sẫm" | 1 | 5 | 85,4678(3)2 | 1,532 | 312,46 | 961 | 0,363 | 0,82 | 90 |
| 38 | Sr | Stronti | Strontium | đặt theo địa danh Strontian - một thị trấn ở Scotland | 2 | 5 | 87,62(1)2 4 | 2,64 | 1050 | 1655 | 0,301 | 0,95 | 370 |
| 39 | Y | Ytri | Ytrium | đặt theo địa danh Ytterby, Thụy Điển | 3 | 5 | 88,90585(2) | 4,469 | 1799 | 3609 | 0,298 | 1,22 | 33 |
| 40 | Zr | Zirconi | Zirconium | tiếng Ba Tư zargun, nghĩa là "có màu của vàng" | 4 | 5 | 91,224(2)2 | 6,506 | 2128 | 4682 | 0,278 | 1,33 | 165 |
| 41 | Nb | Niobi | Niobium | đặt theo tên của Niobe - con gái vua Tantalus trong thần thoại Hy Lạp | 5 | 5 | 92,90638(2) | 8,57 | 2750 | 5017 | 0,265 | 1,6 | 20 |
| 42 | Mo | Molypden | Molybdenum | tiếng Hy Lạp molybdos, nghĩa là "chì" | 6 | 5 | 95,96(2)2 | 10,22 | 2896 | 4912 | 0,251 | 2,16 | 1,2 |
| 43 | Tc | Tecneti | Technetium | tiếng Hy Lạp tekhnetos, nghĩa là "nhân tạo" | 7 | 5 | [98]1 | 11,5 | 2430 | 4538 | – | 1,9 | <0,001 |
| 44 | Ru | Rutheni | Ruthenium | tiếng Latinh Ruthenia, nghĩa là "Nga" | 8 | 5 | 101,07(2)2 | 12,37 | 2607 | 4423 | 0,238 | 2,2 | 0,001 |
| 45 | Rh | Rhodi | Rhodium | tiếng Hy Lạp rhodon, nghĩa là "có màu hoa hồng" | 9 | 5 | 102,90550(2) | 12,41 | 2237 | 3968 | 0,243 | 2,28 | 0,001 |
| 46 | Pd | Paladi | Paladium | đặt theo theo tên của tiểu hành tinh 2 Pallas - có thời từng được xem là hành tinh | 10 | 5 | 106,42(1)2 | 12,02 | 1828,05 | 3236 | 0,244 | 2,2 | 0,015 |
| 47 | Ag | Bạc | Silver (Argentum) | tiếng Latinh argentum[2] | 11 | 5 | 107,8682(2)2 | 10,501 | 1234,93 | 2435 | 0,235 | 1,93 | 0,075 |
| 48 | Cd | Cadmi | Cadmium | tiếng Latinh cadmia (khoáng chất calmine) | 12 | 5 | 112,411(8)2 | 8,69 | 594,22 | 1040 | 0,232 | 1,69 | 0,159 |
| 49 | In | Indi | Indium | tiếng Latinh indicium, nghĩa là "màu tím" hoặc "màu chàm" | 13 | 5 | 114,818(1) | 7,31 | 429,75 | 2345 | 0,233 | 1,78 | 0,25 |
| 50 | Sn | Thiếc | Tin (Stannum) | ký hiệu Sn ứng với tên tiếng Latinh stannum, nghĩa là "cứng" | 14 | 5 | 118,710(7)2 | 7,287 | 505,08 | 2875 | 0,228 | 1,96 | 2,3 |
| 51 | Sb | Antimon | Antimony (Stibium) | tiếng Hy Lạp anti – monos, nghĩa là "không đơn độc" (tiếng Latinh: stibium) | 15 | 5 | 121,760(1)2 | 6,685 | 903,78 | 1860 | 0,207 | 2,05 | 0,2 |
| 52 | Te | Teluride | Tellurium | tiếng Latinh tellus, nghĩa là "Trái Đất" | 16 | 5 | 127,60(3)2 | 6,232 | 722,66 | 1261 | 0,202 | 2,1 | 0,001 |
| 53 | I | Iod | Iodine | tiếng Hy Lạp iodes, nghĩa là "màu tím" | 17 | 5 | 126,90447(3) | 4,93 | 386,85 | 457,4 | 0,214 | 2,66 | 0,45 |
| 54 | Xe | Xenon | Xenon | tiếng Hy Lạp xenos, nghĩa là "kẻ lạ" | 18 | 5 | 131,293(6)2 3 | 0,005887 | 161,4 | 165,03 | 0,158 | 2,6 | <0,001 |
| 55 | Cs | Xêzi | Caesium | tiếng Latinh caesius, nghĩa là "màu xanh da trời" | 1 | 6 | 132,9054519(2) | 1,873 | 301,59 | 944 | 0,242 | 0,79 | 3 |
| 56 | Ba | Bari | Barium | tiếng Hy Lạp barys, nghĩa là "nặng" | 2 | 6 | 137,327(7) | 3,594 | 1000 | 2170 | 0,204 | 0,89 | 425 |
| 57 | La | Lanthan | Lanthanum | tiếng Hy Lạp lanthanein, nghĩa là "nằm ẩn giấu" | 6 | 138,90547(7)2 | 6,145 | 1193 | 3737 | 0,195 | 1,1 | 39 | |
| 58 | Ce | Xeri | Cerium | đặt tên tên vị thần nông nghiệp Ceres trong thần thoại La Mã | 6 | 140,116(1)2 | 6,77 | 1068 | 3716 | 0,192 | 1,12 | 66,5 | |
| 59 | Pr | Praseodymi | Praseodymium | tiếng Hy Lạp prasios didymos, nghĩa là "cặp song sinh xanh lục" | 6 | 140,90765(2) | 6,773 | 1208 | 3793 | 0,193 | 1,13 | 9,2 | |
| 60 | Nd | Neodymi | Neodymium | tiếng Hy Lạp neos didymos, nghĩa là "cặp song sinh mới" | 6 | 144,242(3)2 | 7,007 | 1297 | 3347 | 0,19 | 1,14 | 41,5 | |
| 61 | Pm | Promethi | Promethium | đặt theo tên Prometheus trong thần thoại Hy Lạp. Prometheus là người đã đánh cắp lửa từ các thần và giao nó cho con người. | 6 | [145]1 | 7,26 | 1315 | 3273 | – | 1,13 | <0,001 | |
| 62 | Sm | Samari | Samarium | samari lần đầu tiên được cô lập là từ khoáng chất samarskite | 6 | 150,36(2)2 | 7,52 | 1345 | 2067 | 0,197 | 1,17 | 7,05 | |
| 63 | Eu | Europi | Europium | đặt theo địa danh "Châu Âu" | 6 | 151,964(1)2 | 5,243 | 1099 | 1802 | 0,182 | 1,2 | 2 | |
| 64 | Gd | Gadolini | Gadonlinium | đặt theo họ nhà hóa học, vật lý học và khoáng vật học Johan Gadolin | 6 | 157,25(3)2 | 7,895 | 1585 | 3546 | 0,236 | 1,2 | 6,2 | |
| 65 | Tb | Terbi | Terbium | đặt theo địa danh Ytterby, Thụy Điển | 6 | 158,92535(2) | 8,229 | 1629 | 3503 | 0,182 | 1,2 | 1,2 | |
| 66 | Dy | Dysprosi | Dysprosium | tiếng Hy Lạp dysprositos, nghĩa là "khó lấy được" | 6 | 162,500(1)2 | 8,55 | 1680 | 2840 | 0,17 | 1,22 | 5,2 | |
| 67 | Ho | Holmi | Holmium | tiếng Latinh Holmia, nghĩa là "Stockholm", Thụy Điển | 6 | 164,93032(2) | 8,795 | 1734 | 2993 | 0,165 | 1,23 | 1,3 | |
| 68 | Er | Erbi | Erbium | đặt theo địa danh Ytterby, Thụy Điển | 6 | 167,259(3)2 | 9,066 | 1802 | 3141 | 0,168 | 1,24 | 3,5 | |
| 69 | Tm | Thuli | Thulium | đặt theo địa danh Thule - tên cổ của Scandinavia | 6 | 168,93421(2) | 9,321 | 1818 | 2223 | 0,16 | 1,25 | 0,52 | |
| 70 | Yb | Yterbi | Yterbium | đặt theo địa danh Ytterby, Thụy Điển | 6 | 173,054(5)2 | 6,965 | 1097 | 1469 | 0,155 | 1,1 | 3,2 | |
| 71 | Lu | Luteti | Lutetium | đặt theo địa danh La Mã Lutetia, nghĩa là "Paris", Pháp | 3 | 6 | 174,9668(1)2 | 9,84 | 1925 | 3675 | 0,154 | 1,27 | 0,8 |
| 72 | Hf | Hafni | Hafnium | đặt theo địa danh trong tiếng Latinh là Hafnia, nghĩa là "Copenhagen", Đan Mạch | 4 | 6 | 178,49(2) | 13,31 | 2506 | 4876 | 0,144 | 1,3 | 3 |
| 73 | Ta | Tantali | Tantalum | đặt theo danh xưng của vua Tantalus - cha của Niobe trong thần thoại Hy Lạp | 5 | 6 | 180,94788(2) | 16,654 | 3290 | 5731 | 0,14 | 1,5 | 2 |
| 74 | W | Wolfram | Tungsten (Wolfram) | wolfram là tên cũ của khoáng chất wolframite[2] | 6 | 6 | 183,84(1) | 19,25 | 3695 | 5828 | 0,132 | 2,36 | 1,3 |
| 75 | Re | Rheni | Rhenium | tiếng Latinh Rhenia, nghĩa là sông "Rhine" - con sông chảy từ Graubünden ở đông Anpơ Thụy Sĩ ra bờ biển Bắc ở Hà Lan | 7 | 6 | 186,207(1) | 21,02 | 3459 | 5869 | 0,137 | 1,9 | <0,001 |
| 76 | Os | Osmi | Osmium | tiếng Hy Lạp osme, nghĩa là "mùi" | 8 | 6 | 190,23(3)2 | 22,61 | 3306 | 5285 | 0,13 | 2,2 | 0,002 |
| 77 | Ir | Iridi | Iridium | đặt theo tên thần Iris - nữ thần cầu vồng trong thần thoại Hy Lạp | 9 | 6 | 192,217(3) | 22,56 | 2719 | 4701 | 0,131 | 2,2 | 0,001 |
| 78 | Pt | Platin | Plantinum | tiếng Tây Ban Nha platina, nghĩa là "bạc nhỏ" | 10 | 6 | 195,084(9) | 21,46 | 2041,4 | 4098 | 0,133 | 2,28 | 0,005 |
| 79 | Au | Vàng | Gold (Aurum) | ký hiệu Au ứng với tên tiếng Latinh aurum, nghĩa là "quầng sáng của bình minh"[2] | 11 | 6 | 196,966569(4) | 19,282 | 1337,33 | 3129 | 0,129 | 2,54 | 0,004 |
| 80 | Hg | Thủy ngân | Mercury (Hydrargyrum) | ký hiệu Hg ứng với tên cũ hydrargyrum, trong đó hydr- và argyros lần lượt có nghĩa là "nước" và "bạc" (trong tiếng Hy Lạp). | 12 | 6 | 200,592(3) | 13,5336 | 234,43 | 629,88 | 0,14 | 2 | 0,085 |
| 81 | Tl | Tali | Thalium | tiếng Hy Lạp thallos, nghĩa là "nhánh cây con màu lục" | 13 | 6 | 204,389 | 11,85 | 577 | 1746 | 0,129 | 1,62 | 0,85 |
| 82 | Pb | Chì | Lead (Plumbum) | ký hiệu Pb ứng với tên tiếng Latinh plumbum[2] | 14 | 6 | 207,2(1)2 4 | 11,342 | 600,61 | 2022 | 0,129 | 1,87 | 14 |
| 83 | Bi | Bismuth | Bismuth | tiếng Đức 'Bisemutum'; đây vốn là cách viết sai của cụm từ Weisse Masse, nghĩa là "vật chất trắng" | 15 | 6 | 208,98040(1)1 | 9,807 | 544,7 | 1837 | 0,122 | 2,02 | 0,009 |
| 84 | Po | Poloni | Polonium | tiếng Latinh Polonia, nghĩa là "Ba Lan" - quê quán của Marie Curie, người đầu tiên cô lập nguyên tố này | 16 | 6 | [209]1 | 9,32 | 527 | 1235 | – | 2,0 | <0,001 |
| 85 | At | Astatin | Astatine | tiếng Hy Lạp astatos, nghĩa là "không ổn định" | 17 | 6 | [210]1 | 7 | 575 | 610 | – | 2,2 | <0,001 |
| 86 | Rn | Radon | Radon | đặt theo tên của nguyên tố radi, bởi vì đầu tiên radon được phát hiện khi nó thoát ra từ radi trong quá trình phân rã phóng xạ | 18 | 6 | [222]1 | 0,00973 | 202 | 211,3 | 0,094 | 2,2 | <0,001 |
| 87 | Fr | Franci | Francium | nghĩa là "Pháp" - nơi lần đầu tiên phát hiện ra nguyên tố này | 1 | 7 | [223]1 | 1,87 | 300 | 950 | – | 0,7 | <0,001 |
| 88 | Ra | Radi | Radium | tiếng Latinh radius, nghĩa là "tia" | 2 | 7 | [226]1 | 5,5 | 973 | 2010 | 0,094 | 0,9 | <0,001 |
| 89 | Ac | Actini | Actinium | tiếng Hy Lạp actinos, nghĩa là "một tia" | 7 | [227]1 | 10,07 | 1323 | 3471 | 0,12 | 1,1 | <0,001 | |
| 90 | Th | Thori | Thorium | đặt theo tên thần sấm Thor trong thần thoại Scandinavia | 7 | 232,03806(2)1 2 | 11,72 | 2115 | 5061 | 0,113 | 1,3 | 9,6 | |
| 91 | Pa | Protactini | Protactinium | tiền tố protos trong tiếng Hy Lạp có nghĩa là "đầu tiên", bởi lẽ actini được tạo ra thông qua quá trình phân rã phóng xạ của protactini | 7 | 231,03588(2)1 | 15,37 | 1841 | 4300 | – | 1,5 | <0,001 | |
| 92 | U | Urani | Uranium | nghĩa là "sao Thiên Vương" | 7 | 238,02891(3)1 | 18,95 | 1405,3 | 4404 | 0,116 | 1,38 | 2,7 | |
| 93 | Np | Neptuni | Neptunium | nghĩa là "sao Hải Vương" | 7 | [237]1 | 20,45 | 917 | 4273 | – | 1,36 | <0,001 | |
| 94 | Pu | Plutoni | Plutonium | nghĩa là "sao Diêm Vương" | 7 | [244]1 | 19,84 | 912,5 | 3501 | – | 1,28 | <0,001 | |
| 95 | Am | Americi | Americium | nghĩa là "châu Mỹ" | 7 | [243]1 | 13,69 | 1449 | 2880 | – | 1,13 | <0,001 | |
| 96 | Cm | Curi | Curium | đặt theo họ của nhà vật lý học Pierre Curie và nhà vật lý học - hóa học Marie Curie | 7 | [247]1 | 13,51 | 1613 | 3383 | – | 1,28 | <0,001 | |
| 97 | Bk | Berkeli | Berkelium | đặt theo địa danh Berkeley, California, Hoa Kỳ - nơi lần đầu tiên tổng hợp nguyên tố này | 7 | [247]1 | 14,79 | 1259 | 2900 | – | 1,3 | <0,001 | |
| 98 | Cf | Californi | Californium | đặt theo địa danh California, Hoa Kỳ - nơi lần đầu tiên tổng hợp nguyên tố này | 7 | [251]1 | 15,1 | 1173 | (1743)11 | – | 1,3 | <0,001 | |
| 99 | Es | Einsteini | Einsteinium | đặt theo họ của nhà vật lý học Albert Einstein | 7 | [252]1 | 8,84 | 1133 | (1269)11 | – | 1,3 | 0 8 | |
| 100 | Fm | Fermi | Fermium | đặt theo họ của nhà vật lý học Enrico Fermi | 7 | [257]1 | – | (1800)11 | – | – | 1,3 | 0 8 | |
| 101 | Md | Mendelevi | Mendelevium | đặt theo họ của nhà hóa học và nhà phát minh Dmitri Ivanovich Mendeleev | 7 | [258]1 | – | (1100)11 | – | – | 1,3 | 0 8 | |
| 102 | No | Nobeli | Nobelium | đặt theo họ của nhà hóa học, kỹ sư, nhà phát minh, nhà sản xuất vũ khí Alfred Nobel | 7 | [259]1 | – | (1100)11 | – | – | 1,3 | 0 8 | |
| 103 | Lr | Lawrenci | Lawrencium | đặt theo họ của nhà vật lý học Ernest Lawrence | 3 | 7 | [262]1 | – | (1900)11 | – | – | 1,3 | 0 8 |
| 104 | Rf | Rutherfordi | Rutherfordium | đặt theo họ của nhà vật lý học - hóa học Ernest Rutherford | 4 | 7 | [267]1 | (23,2)11 | (2400)11 | (5800)11 | – | – | 0 8 |
| 105 | Db | Dubni | Dubnium | đặt theo địa danh Dubna, Nga | 5 | 7 | [268]1 | (29,3)11 | – | – | – | – | 0 8 |
| 106 | Sg | Seaborgi | Seaborgium | đặt theo họ của nhà khoa học Glenn Seaborg | 6 | 7 | [269]1 | (35,0)11 | – | – | – | – | 0 8 |
| 107 | Bh | Bohri | Bohrium | đặt theo họ của nhà vật lý học Niels Bohr | 7 | 7 | [270]1 | (37,1)11 | – | – | – | – | 0 8 |
| 108 | Hs | Hassi | Hassium | đặt theo địa danh Hessen, Đức - nơi đầu tiên tổng hợp nguyên tố này | 8 | 7 | [269]1 | (40,7)11 | – | – | – | – | 0 8 |
| 109 | Mt | Meitneri | Meitnerium | đặt theo họ của nhà vật lý học Lise Meitner | 9 | 7 | [278]1 | (37,4)11 | – | – | – | – | 0 8 |
| 110 | Ds | Darmstadti | Darmstadtium | đặt theo địa danh Darmstadt, Đức - nơi đầu tiên tổng hợp nguyên tố này | 10 | 7 | [281]1 | (34,8)11 | – | – | – | – | 0 8 |
| 111 | Rg | Roentgeni | Roentgenium | đặt theo họ của nhà vật lý học Wilhelm Röntgen | 11 | 7 | [281]1 | (28,7)11 | – | – | – | – | 0 8 |
| 112 | Cn | Copernixi | Copernicium | đặt theo họ của nhà thiên văn học Nicolaus Copernicus | 12 | 7 | [285]1 | (23,7)11 | – | 357 12 | – | – | 0 8 |
| 113 | Nh | Nihoni | Nihonium | tiếng Nhật nihon nghĩa là Nhật Bản - nơi đầu tiên tổng hợp nguyên tố này | 13 | 7 | [286]1 | (16)11 | (700)11 | (1400)11 | – | – | 0 8 |
| 114 | Fl | Flerovi | Flerovium | đặt theo họ của nhà vật lý học Georgy Flyorov | 14 | 7 | [289]1 | (14)11 | (340)11 | (420)11 | – | – | 0 8 |
| 115 | Mc | Moscovi | Moscovium | Moskva, Nga - nơi đầu tiên tổng hợp nguyên tố này | 15 | 7 | [288]1 | (13,5)11 | (700)11 | (1400)11 | – | – | 0 8 |
| 116 | Lv | Livermori | Livermorium | đặt theo tên Phòng thí nghiệm Quốc gia Lawrence Livermore (ở Livermore, California) - đơn vị đã hợp tác cùng Viện Liên hợp Nghiên cứu Hạt nhân tổng hợp ra nguyên tố này | 16 | 7 | [293]1 | (12,9)11 | (708,5)11 | (1085)11 | – | – | 0 8 |
| 117 | Ts | Tennessine | Tennessine | Tennessee, Hoa Kỳ | 17 | 7 | [294]1 | (7,2)11 | (673)11 | (823)11 | – | – | 0 8 |
| 118 | Og | Oganesson | Oganesson | đặt theo họ của nhà vật lý học Yuri Oganessian | 18 | 7 | [294]1 | (5,0)11 13 | (258)11 | (263)11 | – | – | 0 8 |
Bạn có thể vào link https://vi.wikipedia.org/wiki/Danh_s%C3%A1ch_nguy%C3%AAn_t%E1%BB%91_h%C3%B3a_h%E1%BB%8Dc để tham khảo nha.

a)$NaOH + HCl \to NaCl + H_2O$
Theo PTHH :
$n_{NaCl} = n_{NaOH} = 0,2.1 = 0,2(mol)$
$m_{NaCl} = 0,2.58,5 = 11,7(gam)$
b) $V_{dd\ X} = 0,2 + 0,2 = 0,4(lít)$
$C_{M_{NaCl}} = \dfrac{0,2}{0,4} = 0,5M$

a) \(\sum n_{HCl}=\dfrac{9,125+5,475}{36,5}=0,4\left(mol\right)\)
`=>` \(C_{M\left(ddC\right)}=\dfrac{0,4}{2}=0,2M\)
b) Gọi \(\left\{{}\begin{matrix}C_{M\left(ddA\right)}=xM\\C_{M\left(ddB\right)}=yM\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}V_1=\dfrac{9,125}{36,5.x}=\dfrac{0,25}{x}\left(mol\right)\\V_2=\dfrac{5,475}{36,5.y}=\dfrac{0,15}{y}\left(mol\right)\end{matrix}\right.\)
`=>` Ta có: \(\left\{{}\begin{matrix}x-y=0,4\\\dfrac{0,25}{x}+\dfrac{0,15}{y}=2\end{matrix}\right.\)
`=>` \(\left[{}\begin{matrix}\left\{{}\begin{matrix}x=0,1M\\y=-0,3M\end{matrix}\right.\left(\text{Loại}\right)\\\left\{{}\begin{matrix}x=0,5M\\y=0,1M\end{matrix}\right.\left(\text{Chọn}\right)\end{matrix}\right.\)

a 0,9333... b 1,5 c 0,75 d 0,625 e 0,9 g 0,56
ta có \(\dfrac{1}{10}=\dfrac{4}{40};\dfrac{2}{10}=\dfrac{8}{40}\)
\(\dfrac{1}{40}< \dfrac{2}{40}< \dfrac{3}{40}< \dfrac{4}{40}< \dfrac{5}{40}< \dfrac{6}{40}< \dfrac{7}{40}< \dfrac{8}{40}\) vậy ta có các số \(\dfrac{2}{40};\dfrac{3}{40};\dfrac{4}{40};\dfrac{5}{40};\dfrac{6}{40};\dfrac{7}{40}\) bé hơn \(\dfrac{1}{10}\)và lớn hơn \(\dfrac{2}{10}\)

a) \(n_{KMnO_4}=\dfrac{12,64}{158}=0,08\left(mol\right)\)
Ta có: \(m_{giảm}=m_{O_2}=12,64-11,68=0,96\left(mol\right)\)
`=>` \(n_{O_2}=\dfrac{0,96}{32}=0,03\left(mol\right)\)
PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,06\left(mol\right)\)
`=>` \(H=\dfrac{0,06}{0,08}.100\text{%}=75\%\)
b) Theo PT: \(n_{K_2MnO_4}=n_{MnO_2}=n_{O_2}=0,03\left(mol\right)\)
Ta có: \(n_{KMnO_4\left(dư\right)}=0,08-0,06=0,02\left(mol\right)\)
`=>` \(n_O=0,02.4+0,03.4+0,03.2=0,26\left(mol\right)\)
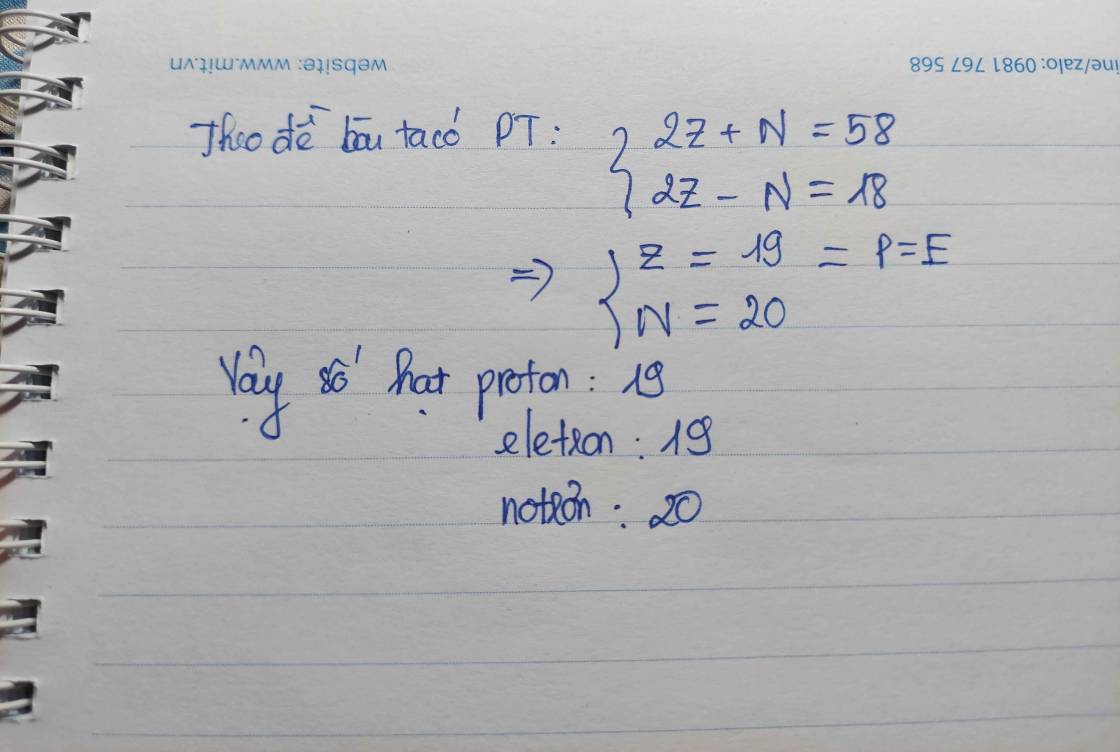
Động vật, cây cối, sông suối, ao hồ là những vật thể tự nhiên. Sách, vở, ti vi, xe máy, quạt điện là những vật thể nhân tạo