Câu 1 Hoàn thành các PTHH theo chuỗi biến hóa sau:
a) K2O -> K2SO4 -> KCL -> KOH -> KCl
b) MgO -> MgS04 -> MgCl2 -> Mg(OH)2 -> MgO
Câu 2 Cho từ từ 200 gam dung dịch NaOH 10% vào 300 gam dung dịch H2SO4 10%
a) Chất nào còn dư sau phản ứng? Dung dịch sau phản ứng làm quỳ tím đổi màu gì ?
b) Tính khối lượng và nồng độ các chất có trong dung dịch sau phản ứng ?
c) Nêu một số ứng dụng của NaOH trong đời sống và sản xuất
Câu 3 Cho từ từ 740 gam dung dịch Ca(OH)2 20% vào 730 gam dung dịch HCl 10%
a) Chất nào còn dư sau phản ứng?Dung dịch sau phản ứng làm quỳ tím đổi màu gì
b) Tính khối lượng và nồng độ các chất có trong dung dịch sau phản ứng
c) Nêu một số ứng dụng của Ca(OH)2 trong đời sống và sản xuất
BẠN NÀO GIÚP MÌNH GIẢI 3 BÀI TRÊN VỚI MAI MÌNH PHẢI THI R

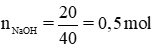
Câu 1 :
a ) \(K_2O+H_2SO_4\rightarrow K_2SO_4+H_2O\)
\(K_2SO_4+2HCl\rightarrow2KCl+H_2SO_4\)
\(KCl+NaOH\rightarrow KOH+NaCl\)
\(KOH+HCl\rightarrow KCl+H_2O\)
b) Ý b cũng tương tự ý a nha . Chỉ cần thay đổi 1 chút thôi .
Câu 2 :
Theo bài ra , ta có : \(\hept{\begin{cases}n_{NaOH}=\frac{200.10}{100.40}=0,5\left(mol\right)\\n_{H_2SO_4}=\frac{300.10}{100.98}\approx0,3\left(mol\right)\end{cases}}\)
+) \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
Ta có : \(\frac{0,5}{2}=0,25< \frac{0,3}{1}=0,3\)
=> NaOH phản ứng hết , H2SO4 còn dư
=> Mọi tinh toán tính theo NaOH
+) Dung dịch tạo ra sau phản ứng không làm quỳ tím đổi màu .
b) \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
Theo PTHH : 2 mol 1 mol 2 mol
Theo bài : 0,5 mol 0,25 mol 0,5 mol
\(\Rightarrow\hept{\begin{cases}m_{Na_2SO_4}=142.0,25=33,5\left(g\right)\\m_{H_2O}=18.0,5=9\left(g\right)\end{cases}}\)
Bài dưới cũng tương tự nha