lúc 7h sáng hằng đi xe đạp từ nhà lên huyện với quãng đường 10km , sau khi đi được 4km với vận tốc 10km/h thì xe bị hỏng . hằng đã dừng lại để sửa xe mất 15 phút quãng đường còn lại hằng đi hết 30 min
giúp mình với ạ !
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tóm tắt :
Biết : R1=3Ω�1=3Ω ; R2=5Ω�2=5Ω ; R3=7Ω�3=7Ω
U=6V�=6�
Tính : a. Rtđ=?��đ=?
b. U1=?�1=? ; U2=?�2=? ; U3=?�3=?
Giải
b. CĐDĐ qua mạch chính là :
I=UR=615=0,4A�=��=615=0,4�
Do R1�1 nt R2�2 nt R3�3 nên :
I=I1=I2=I3=0,4A�=�1=�2=�3=0,4�
HĐT giữa hai đầu mỗi điện trở là :
U1=I1.R1=0,4.3=1,2V�1=�1.�1=0,4.3=1,2�
U2=I2.R2=0,4.5=2V�2=�2.�2=0,4.5=2�
U3=I3.R3=0,4.7=2,8V�3=�3.�3=0,4.7=2,8�
Đáp số U1=1,2V�1=1,2� ; U2=2V�2=2� ; U3=2,8V
ko bit đúng ko nũa

CTM: \(R_1ntR_2\)
\(R_{tđ}=R_1+R_2\), mà \(R_2=3R_1\) nên:
\(R_{tđ}=R_1+3R_1=4R_1=17\) \(\Rightarrow R_1=\dfrac{17}{4}\Omega=4,25\Omega\)
\(\Rightarrow R_2=3R_1=3\cdot4,25=12,75\Omega\)

Vận tốc 12km -> 12km/h
Tổng độ dài quãng đường người đó đi: 8+ 12=20(km)
Thời gian người đó đi quãng đường đầu tiên là:
8:12 x 60 = 40 (phút)
Tổng thời gian người đó đi:
40+80=120(phút)=2 giờ
Tốc độ của người đi xe đạp trên cả quãng đường:
20:2=10(km/h)
Đáp số: 10km/h

\(a,R_{tđ}=R_1+R_2=20+30=50\Omega\)
\(I_2=I_1=I_m=\dfrac{U_2}{R_2}=\dfrac{15}{30}=0,5\left(A\right)\)
\(b,A=P.t=0,5.50.0,5.20.60=15000\left(J\right)\)

Để mắt thấy được ảnh của chân thì mép dưới của gương cách mặt đất một đoạn nhiều nhất là đoạn NK.
Xét \(\Delta B'BI\) có \(NK\) là đường trung bình nên:
\(NK=\dfrac{IB}{2}=\dfrac{BA-AI}{2}=\dfrac{150-10}{2}=\dfrac{140}{2}=70cm=0,7m\)
Như vậy, người đó soi gương có thể nhìn thấy \(\dfrac{0,7}{1,5}\approx47\%\) cơ thể.
Để người đó nhìn thấy toàn bộ cơ thể thì mép trên của gương cách cách mặt đất ít nhất là đoạn NK.
Xét \(\Delta AII'\) có \(MH\) là đường trung bình nên:
\(MH=\dfrac{AI}{2}=\dfrac{10}{2}=5cm=0,05m\)
Mà \(MK=MH+HK=MH+IB=0,05+1,4=1,45m\)
Chiều cao gương để thỏa mãn điều kiện trên:
\(MN=MK-NK=1,45-0,7=0,75m\)
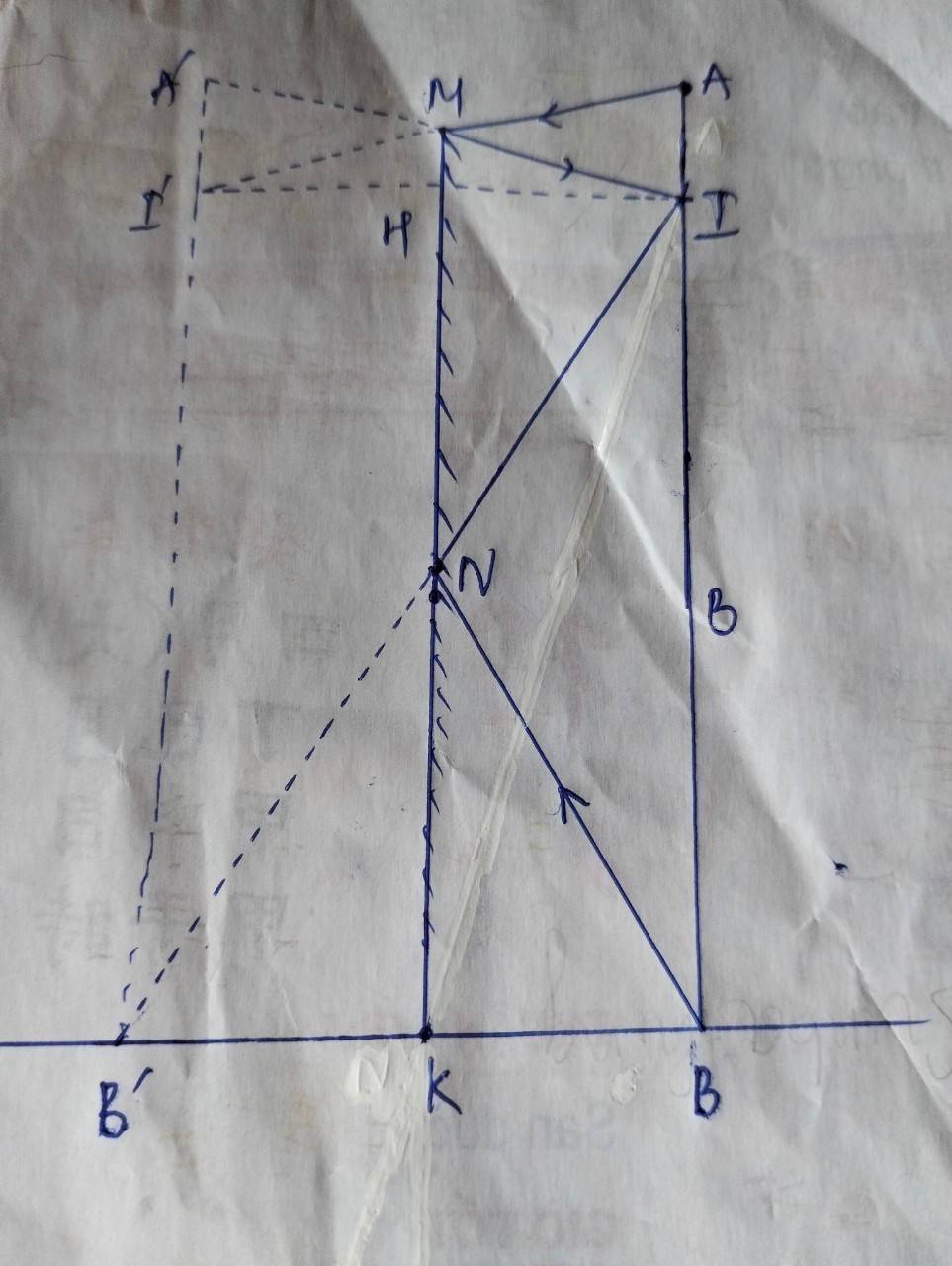
đính chính lại cái ảnh chút, em xóa cái chữ B ở trên đi nhé, chị quên chưa xóa hết
Vì 12 ,102 và 140 là số chẵn nên
a, Để tổng A chia hết cho 2 thì x phải là số chẵn
b, Để tổng A không chia hết cho 2 thì x phải là số lẻ