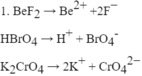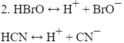Viết phương trình điện li của H2SO4; Al2(SO4)3; BaSO4; FeCl3; H3PO4; HF; CH3COOH
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Chất điện li mạnh
\(HBr\rightarrow H^++Br^-\)
\(Na_2S\rightarrow2Na^++S^{2-}\)
\(KOH\rightarrow K^++OH^-\)
\(H_2SO_4\rightarrow2H^++SO_4^{2-}\)
\(Ba\left(OH\right)_2\rightarrow Ba^{2+}+2OH^-\)
\(AlCl_3\rightarrow Al^{3+}+3Cl^-\)
- Chất điện li yếu
\(CH_3COOH⇌CH_3COO^-+H^+\)
\(Mg\left(OH\right)_2⇌Mg\left(OH\right)^++OH^-\)
\(Mg\left(OH\right)^+⇌Mg^{2+}+OH^-\)

\(HClO\rightarrow H^++ClO^-\)
\(KNO_3\rightarrow K^++NO_3^-\)
\(\left(NH_4\right)_2SO_4\rightarrow2NH_4^++SO_4^{2-}\)
\(NaHCO_3\rightarrow Na^++HCO^-_3\left(HCO_3^-\leftrightarrow H^++CO_3^{2-}\right)\)
\(Na_3PO_4\rightarrow3Na^++PO_4^{3-}\)

- Sự điện li là sự phân li thành các cation (ion dương) và anion (ion âm) của phân tử chất điện li khi tan trong nước.
- Chất điện li là những chất tan trong nước và tạo thành dung dịch dẫn được điện.
- Các chất là chất điện li như axit, các bazơ, các muối tan được trong nước.
- Chất điện li mạnh là những chất khi tan trong nước các phân tử hoà tan đều phân li ra ion.
- Thí dụ:
H2SO4 → 2H+ + SO42-
KOH → K+ + OH-
Na2SO4 → 2Na+ + SO42-
- Chất điện li yếu là những chất khi tan trong nước chỉ có một phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
- Thí dụ: H2S ⇌ H+ + HS-

a, \(Ba\left(NO_3\right)_2\rightarrow Ba^{2+}+2NO_3^-\)
\(HNO_3\rightarrow H^++NO_3^-\)
\(KOH\rightarrow K^++OH^-\)
b, \(HClO⇌H^++ClO^-\)
\(HNO_2⇌H^++NO_2^-\)
\(H_2CO_3⇌2H^++CO_3^{2-}\)

a) Chất điện li :
$NaCl \to Na^+ + Cl^-$
$Na_2CO_3 \to 2Na^+ + CO_3^{2-}$
$NaHCO_3 \to Na^+ + HCO_3^-$
$K_2SO_4 \to 2K^+ + SO_4^{2-}$
$CaCO_3 \to Ca^{2+} + CO_3^{2-}$
$BaSO_3 \to Ba^{2+} + SO_3^{2-}$
Chất không điện li : NaCl khan
\(NaCl\rightarrow Na^++Cl^-\\ NaCl_{khan}⇌Na^++Cl^-\\ CaCO_3⇌Ca^{2+}+CO^{2-}_3\\ NaHCO_3\rightarrow Na^++HCO^-_3\\ Na_2CO_3\rightarrow2Na^++CO^{2-}_3\\ BaSO_3⇌Ba^{2+}+SO^{2-}_3\\ K_2SO_4\rightarrow2K^++SO^{2-}_4\)

\(NaCl\rightarrow Na^++Cl^-\\ HCl\rightarrow H^++Cl^-\\ Ba\left(OH\right)_2\rightarrow Ba^{2+}+2OH^-\\ AgNO_3\rightarrow Ag^++NO_3^-\\ H_2SO_4\rightarrow2H^++SO^{2-}_4\\ HClO_4\rightarrow H^++ClO^-_4\)