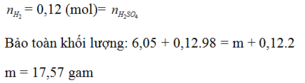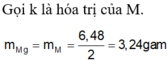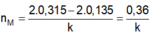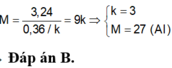Hoà tan hoàn toàn m gam hỗn hợp X gồm Mg; Al; Zn cần vừa đủ 550ml dung dịch H2SO4 aM. Sau khi phản ứng xong khối lượng dung dịch tăng 48,6 gam và thu được 156,4 gam hỗn hợp gồm các muối sunfat trung hoà. Tính aM
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


E có 1 chút nhầm lẫn ở câu cuối
Mg + 2HCl ‐> MgCl + H ﴾1﴿ 2Al + 6HCl ‐> 2AlCl + 3H ﴾2﴿ Fe + 2HCl ‐> FeCl + H ﴾3﴿
Mg + 2HCl -> MgCl2 + H2 (1)
2Al + 6HCl -> 2AlCl3 + 3H2 (2)
Fe + 2HCl -> FeCl2 + H2 (3)
Theo bài ra ta có : nH2 =\(\frac{8,69}{22,4}\) = 0,4 (mol)
Thep ptpu (1)(2)(3) ta thấy
nHCl = 2nH2 = 0,4 .2 = 0,8 (mol)
=> m HCl = 0,8 .36,5 = 26,8 (g)
Ap dụng định luật bảo toàn khối lượng : m hỗn hợpMg ,Al,Fe +m HCl= m muối MgCl2 , ALCL3, FeCl2 +mH2
(=) 15+26,8 =m+0,4.2
(=) 41,8 =m +0,8
=> m=41,8 =0,8=41(g)

n H 2 = 1,344/22,4 = 0,06
n H 2 SO 4 = n H 2 = 0,060
n SO 4 2 - = n H 2 SO 4 = 0,06
m muối = m kim loại + m SO 4 2 - = 3,22 + 0,06 x 96 = 8,98g

Đáp án : C
Ta có : 24nMg + 65nZn = 8,9g
Và nH2 = nMg + nZn = 0,2 mol
=> nMg = nZn = 0,1 mol => %nMg = 50%

Ta có sơ đồ chuyển hoá :
Mg, Zn, Al → O 2 MgO, ZnO, Al 2 O 3
MgO + 2HCl → MgCl 2 + H 2 O
ZnO + 2HCl → ZnCl 2 + H 2 O
Al 2 O 3 + 6HCl → 2 AlCl 3 + 3 H 2 O
MgO, ZnO, Al 2 O 3 → HCl MgCl 2 , ZnCl 2 , AlCl 3
Ta có khối lượng O 2 đã phản ứng : m O 2 = 20,3 - 13,1 = 7,2 (g)
Vậy khối lượng oxi trong hỗn hợp oxit là 7,2 gam.
Toàn bộ lượng oxi trong oxit đã chuyển vào H 2 O nên ta có m O ( H 2 O ) = 7,2g
Cứ 1 mol H 2 O thì chứa 1 mol nguyên tử O ⇒ n H 2 O = n O = 7,2 : 16 = 0,45 mol
Từ phương trình ta có:
n HCl = 2 n H 2 O = 2.0,45 = 0,9 mol
⇒ V HCl = 0,9/0,4 = 2,25l