Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Mình hệ thống lại tính chất hóa học của các loại oxit để bạn dễ học nhé 👇
1. Oxit axit (thường là oxit của phi kim hoặc kim loại có số oxi hoá cao, ví dụ: SO₂, CO₂, P₂O₅, N₂O₅, …)
- Tác dụng với nước → tạo dung dịch axit.
\(S O_{3} + H_{2} O \rightarrow H_{2} S O_{4}\) - Tác dụng với bazơ → tạo muối và nước.
\(C O_{2} + C a \left(\right. O H \left.\right)_{2} \rightarrow C a C O_{3} \downarrow + H_{2} O\)
2. Oxit bazơ (thường là oxit của kim loại, ví dụ: Na₂O, CaO, CuO, Fe₂O₃, …)
- Tác dụng với nước → tạo dung dịch bazơ (nếu oxit tan).
\(C a O + H_{2} O \rightarrow C a \left(\right. O H \left.\right)_{2}\) - Tác dụng với axit → tạo muối và nước.
\(C u O + 2 H C l \rightarrow C u C l_{2} + H_{2} O\)
3. Oxit lưỡng tính (ZnO, Al₂O₃, Cr₂O₃, …)
- Tác dụng với axit → tạo muối và nước.
\(Z n O + 2 H C l \rightarrow Z n C l_{2} + H_{2} O\) - Tác dụng với bazơ mạnh (khi nung nóng hoặc dung dịch kiềm đặc) → tạo muối và nước.
\(Z n O + 2 N a O H \rightarrow N a_{2} Z n O_{2} + H_{2} O\)
4. Oxit trung tính (CO, NO, N₂O, …)
- Không tác dụng với axit, bazơ, muối, cũng không tác dụng với nước.
✅ Tóm gọn:
- Oxit axit + bazơ → muối + nước.
- Oxit bazơ + axit → muối + nước.
- Oxit lưỡng tính + axit/bazơ → muối + nước.
- Oxit trung tính: hầu như không phản ứng.

Tham khảo :
- Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
- Tính chất hoá học của muối:
+ Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
+ Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
+ Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
+ Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
- Mối liên hệ giữa muối và các hợp chất khác được thể hiện bằng sơ đồ sau:

b, Acid là:
+ HCL: hydrochloric acid
+ H2SO4: sulfuric acid
+ HNO3: nitric acid
c, Base là:
+ KOH: potassium hydroxide
+ Ba(OH)2: barium hydroxide
+ Cu(OH)2 : copper (II) hydroxide
d, Muối là:
+ Na2CO3: sodium cacbonat
+ CaSO3 : calcium sunfit
+ NH4Cl : ammonium chloride
+ NaHCO3: sodium hydrogen carbonate
+ CH3COONa: sodium acetat

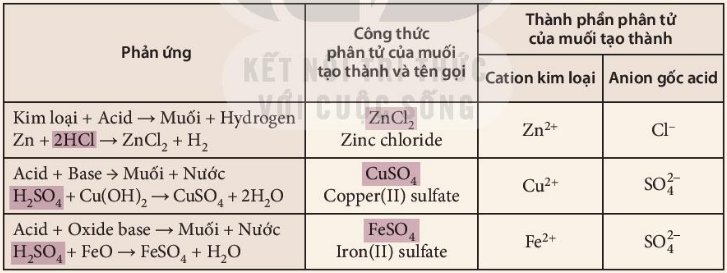
1. Điểm khác nhau giữa thành phần phân tử của acid (chất phản ứng) và muối (chất sản phẩm) là phần tử mang điện dương (cation). (Cation kim loại ở muối và cation H+ ở acid)
Điểm chung của các phản ứng ở Bảng 11.1 là đều có sự thay thế ion H+ của acid bằng ion kim loại.
2. Cách gọi tên muối gồm có cation kim loại và anion gốc acid:
Tên kim loại (hoá trị, đối với kim loại có nhiều hoá trị) + tên gốc acid.

Tham khảo!
- Phản ứng hoá học giữa chất dinh dưỡng với oxygen cung cấp năng lượng cho cơ thể hoạt động là phản ứng toả nhiệt.
- Ví dụ một số phản ứng toả nhiệt:
+ Phản ứng đốt cháy than;
+ Phản ứng đốt cháy khí gas…
Thức ăn được tiêu hoá chuyển thành các chất dinh dưỡng. Phản ứng hoá học giữa chất dinh dưỡng với oxygen cung cấp năng lượng cho cơ thể hoạt động là phản ứng toả nhiệt
Ví dụ phản ứng toả nhiệt: Phản ứng tôi vôi
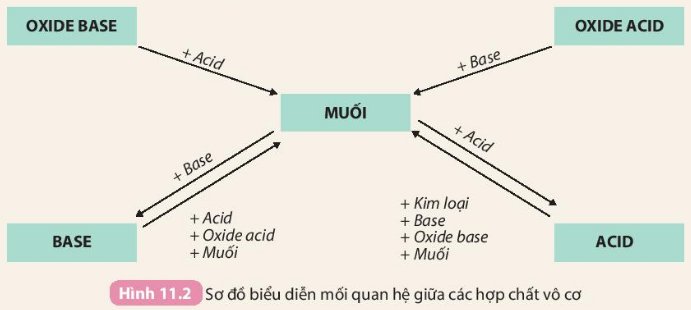
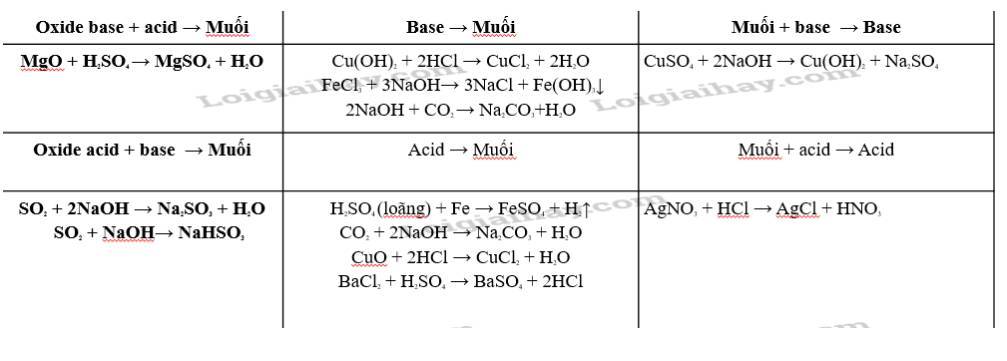

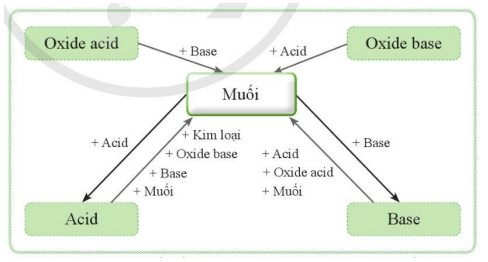
- muối tác dụng với kim loại tạo ra muối mới và kim loại mới (với kim loại tham gia phản ứng mạnh hơn kim loại có trong muối)
- muối tác dụng với aicd tạo thành muối mới và acid mới (với sản phẩm là chất khí, chất kết tủa hoặc nước)
- muối tác dụng với base tạo thành muối mới và base mới (với sản phảm là chất khí, chất kết tủa hoặc nước)
- muối tác dụng với muối tạo thành 2 muối mới (với sản phẩm là chất khí, chất kết tủa hoặc nước)