Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
a. Phản ứng trao đổi:
2H2(g) + O2(g) → 2H2O(g)
b. Phản ứng oxi-hoá khử:
3Fe2O3(s) + H2(g) → 2Fe3O4(s) + H2O(g)
c. Phản ứng thế:
2K(s) + 2H2O(l) → 2KOH(aq) + H2(g)
d. Không có phản ứng nào xảy ra với H2O và P2O2
Câu 2:
a. Phản ứng trao đổi:
H2(g) + O2(g) → H2O(l)
b. Phản ứng oxi-hoá khử:
PbO(s) + H2(g) → Pb(s) + H2O(l)
c. Phản ứng thế:
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
d. Phản ứng trao đổi:
K2O(s) + H2O(l) → 2KOH(aq)
c1
\(a,2H_2+O_2\xrightarrow[]{t^0}2H_2O\\ b,3H_2+Fe_2O_3\xrightarrow[]{t^0}2Fe+3H_2O\\ c,2K+2H_2O\xrightarrow[]{}2KOH+H_2\\ d,3H_2O+P_2O_5\xrightarrow[]{}2H_3PO_4\)
b và c là pư thế
vì phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.

\(a,S+O_2\underrightarrow{t^o}SO_2\) ( hóa hợp )
\(b,2Al+3O_2\underrightarrow{t^o}2Al_2O_3\) ( hóa hợp )
\(c,2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\) ( phân hủy )
\(d,2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\) ( phân hủy )
a) \(S+O_2\xrightarrow[]{t^0}SO_2\left(phản.ứng.hoá.hợp\right)\)
b)\(4Al+3O_2\xrightarrow[t^0]{}2Al_2O_3\left(phản.ứng.hoá.hợp\right)\)
c) \(2KMnO_4\xrightarrow[t^0]{}K_2MnO_4+MnO_2+O_2\left(phản.ứng.phân.huỷ\right)\)
d)\(2KClO_3\xrightarrow[t^0]{}2KCl+3O_2\left(phản.ứng.phân.huỷ\right)\)

1) S+ O2 -t--> SO2(phản ứng hoa hợp)
2) 4P+5O2--t--> 2P2O5 (phản ứng hóa hợp )
3) 3Fe+ 2O2 --t--> Fe3O4 (phản ứng hóa hợp )
4) CH4 + 2O2 --> CO2+2H2O ( phản ứng xãy ra sự Oxi hóa)
5 ) 2KMnO4 --t--> K2MnO4 + MnO2+O2 (phản ứng phân hủy)
6) 2H2 + O2 ----> 2H2O(phản ứng hóa hợp )
7) CuO+H2 --t---> Cu +H2O(Phản ứng oxi hóa -khử)
8) Zn + 2HCl ----> ZnCl2 + H2(phản ứng thế)
(1) S + O2 --->(to) SO2 : pứ hóa hợp
(2) 4P + 5O2 --->(to) 2P2O5 : pứ hóa hợp
(3) 3Fe + 2O2 --->(to) Fe3O4 : pứ hóa hợp
(4) CH4 + 2O2 --->(to) CO2 + 2H2O : pứ oxi hóa
(5) 2 KMnO4 --->(to) K2MnO4 + MnO2 + O2 : pứ phân hủy
(6) 2H2 + O2 --->(to) 2H2O : pứ hóa hợp
(7) CuO + H2 --->(to) Cu + H2O : pứ oxi hóa-khử
(8) Zn + 2HCl ---> ZnCl2 + H2 : pứ thế

Phương trình hóa học biểu diễn các phản ứng:
2H2 + O2 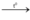 2H2O (pứ hóa hợp + oxi hóa khử)
2H2O (pứ hóa hợp + oxi hóa khử)
4H2 + Fe3O4 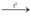 4H2O + 3Fe (pứ thế + oxi hóa khử)
4H2O + 3Fe (pứ thế + oxi hóa khử)
3H2 + Fe2O3 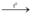 3H2O + 3Fe (pứ thế + oxi hóa khử)
3H2O + 3Fe (pứ thế + oxi hóa khử)
H2 + PbO 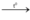 H2O + Pb (pứ thế + oxi hóa khử)
H2O + Pb (pứ thế + oxi hóa khử)
Các phản ứng trên đều là phản ứng oxi – hóa khử vì đều có đồng thời sự khử và sự oxi hóa

\(2H_2+O_2\xrightarrow[]{t^o}2H_2O\\ Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\\ Fe_3O_4+4H_2\xrightarrow[]{t^o}3Fe+4H_2O\\ PbO+H_2\xrightarrow[]{t^o}Pb+H_2O\)

2H2 + O2 -to-> H2O (1)
Fe2O3 + H2 -.to-> 2Fe + 3CO2 (2)
Fe3O4 + 4H2-to-> 3Fe +4H2O (3)
PbO + H2 -to-> Pb + H2O (4)
Các phản ứng trên đều là phản ứng oxi hóa khử
Trong đó, H2 là chất khử vì là chất chiếm oxi của chất khác và O2, Fe3O4, Fe2O3, PbO đều là chất oxi hóa vì là chất nhường oxi cho H2 (phản ứng (1) còn được gọi là phản ứng hóa hợp)

\(1,Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\)
Phản ứng thế
\(2,P_2O_5+3H_2O\rightarrow2H_3PO_4\)
Phản ứng hoá hợp
\(3,Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
Phản ứng thế
\(4,4P+5O_2\xrightarrow[]{t^o}2P_2O_5\)
Phản ứng hoá hợp

a)Cacbon+ Oxi--> Cacbon đioxit
b)điều kiện xảy ra pư:
-Nhiệt độ để nâng nhiệt độ của than
-Đủ khí oxi để duy trì phản ứng
-Cũng có thể đập nhỏ than để tăng bề mặt tiếp xúc của than với oxi
c)Than bén cháy chứng tỏ có phản ứng hóa học xảy ra
d)-Đập nhỏ than để tăng diện tích tiếp xúc của than với oxi
-Quạt mạnh để thêm khí oxi
Chúc em học tốt!!!
a) Cacbon + Oxi --> Cacbonic
b) Điều kiện xảy ra phản ứng hóa học trên:
- Nhiệt độ để nâng nhiệt của than.
- Có đủ khí Oxi để duy trì phản ứng hóa học.
- Tăng bề mặt tiếp xúc của than với khí Oxi bằng cách đập vụn than.
c) Dấu hiệu chứng tỏ có phản ứng hóa học xảy ra là than cháy.
d) -Quạt mạnh hoặc thổi để thêm khí Oxi.
-Đập vụn than để tăng diện tích tiếp xúc với khí Oxi.
CHÚC BẠN HỌC TỐT.![]()

Krypton (Kr) và Fluor (F₂) có thể phản ứng với nhau, tạo ra các hợp chất fluorua krypton.Phản ứng này xảy ra ở điều kiện nhiệt độ và áp suất cao, thường là khi có sự hiện diện của ánh sáng hoặc năng lượng cao.
Công thức hoá học: