Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Mol và tỉ khối chất khí SVIP
1. MOL
Mol là lượng chất có chứa 6,022.1023 hạt (nguyên tử, phân tử hoặc ion) của chất đó.
Số 6,022.1023 được gọi là hằng số Avogadro – NA.
Ví dụ:
- 1 mol nguyên tử nhôm (Al) có chứa 6,022.1023 nguyên tử nhôm.
- 1 mol phân tử sodium chloride (NaCl) có chứa 6,022.1023 phân tử sodium chloride.
Câu hỏi:
@201064483960@
2. KHỐI LƯỢNG MOL
➤ Khái niệm khối lượng mol
Khối lượng mol là khối lượng (tính bằng gam) của 1 mol chất, tức là của NA nguyên tử hoặc phân tử.
Kí hiệu: M.
Đơn vị: g/mol.
- Khối lượng mol có trị số bằng với khối lượng nguyên tử hoặc phân tử, chỉ khác đơn vị.
Ví dụ: 12 gam carbon chứa 1 mol hay 6,022.1023 nguyên tử carbon.

➤ Chuyển đổi giữa số mol và khối lượng
Công thức:

Trong đó:
+ M là khối lượng mol (g/mol).
+ m là khối lượng chất (gam).
+ n là số mol.
Ví dụ: Tính khối lượng mol của nguyên tố magnesium (Mg), biết rằng 0,5 mol magnesium có khối lượng là 12 gam.
Áp dụng công thức khối lượng mol (M), ta có:
\(M=\frac{m}{n}\)
Thay số, ta có:
\(M=\frac{12}{0,5}=24\)
Vậy khối lượng mol của magnesium (Mg) là 24 g/mol.
Câu hỏi:
@201064517661@
3. THỂ TÍCH MOL CHẤT KHÍ
➤ Khái niệm thể tích mol chất khí
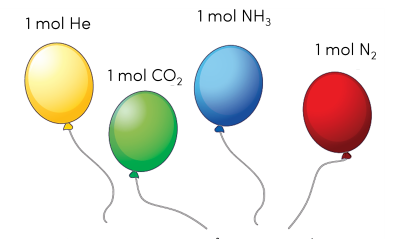
Thể tích mol là thể tích của 1 mol khí (tức 6,022.1023 phân tử) trong điều kiện xác định.
Ở điều kiện chuẩn (25 oC, 1 bar), 1 mol khí bất kì luôn chiếm 24,79 L.
Ví dụ: Thể tích 1 mol của các khí như He, CO2, NH3 hay N2 ở điều kiện chuẩn đều là 24,79 lít.
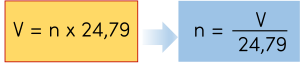
➤ Chuyển đổi giữa số mol và thể tích
Công thức:
Trong đó:
+ M là khối lượng mol (g/mol).
+ V là thể tích chất khí (L).
Ví dụ: Tính thể tích của 0,25 mol khí oxygen (O2) ở điều kiện chuẩn.
Áp dụng công thức về thể tích của chất khí:
\(V=24,79.n\)
Thay số, ta có:
\(V=24,79.0,25=6,1975\)
Vậy thể tích của 0,25 mol khí oxygen ở điều kiện chuẩn là 6,1975 L.
Câu hỏi:
@201064597396@
4. TỈ KHỐI CỦA CHẤT KHÍ
Để xác định khí A nặng hơn hay nhẹ hơn khí B bao nhiêu lần, ta dựa vào tỉ số giữa khối lượng mol:
\(d_{A/B}=\dfrac{M_A}{M_B}\)
Trong đó:
+ \(d_{A/B}\) là tỉ khối của khí A đối với khí B.
+ \(M_A\) và \(M_B\) là khối lượng mol của khí A và khí B (g/mol).
Để biết khí A nặng hay nhẹ hơn không khí bao nhiêu lần, ta tính tỉ khối của khí A so với không khí:
\(D_{A / k k} = \frac{M_{A}}{29}\)
Câu hỏi:
@201001634533@
Bạn có thể đăng câu hỏi về bài học này ở đây