
![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

![]()

Nguyên tử khối trung bình là 16,00447.
Mục tiêu: Tính tổng số nguyên tử của tất cả các đồng vị khi có 1 mol.
1 mol bất kỳ chất chứa \(N_{A} = 6 , 022 \cdot 10^{23}\) hạt (Avogadro).
Vì câu hỏi yêu cầu "tổng số nguyên tử của tất cả các đồng vị", một mol Oxi (O) sẽ có tổng số nguyên tử:
\(N_{\text{t}ổ\text{ng}} = N_{A} = 6 , 022 \cdot 10^{23} \&\text{nbsp};\text{nguy} \hat{\text{e}} \text{n}\&\text{nbsp};\text{t}ử\)
\(^{16} \text{O} : 99 , 757 \% \approx 0 , 99757\)\(^{17} \text{O} : 0 , 038 \% \approx 0 , 00038\)\(^{18} \text{O} : 0 , 205 \% \approx 0 , 00205\)
\(N_{16} = 0 , 99757 \cdot 6 , 022 \cdot 10^{23} \approx 6 , 007 \cdot 10^{23}\) \(N_{17} = 0 , 00038 \cdot 6 , 022 \cdot 10^{23} \approx 2 , 29 \cdot 10^{20}\) \(N_{18} = 0 , 00205 \cdot 6 , 022 \cdot 10^{23} \approx 1 , 23 \cdot 10^{21}\)
\(N_{\text{t}ổ\text{ng}} \approx 6 , 022 \cdot 10^{23}\)
✅ Khớp với bước 1.
Nếu bạn muốn, mình có thể giải chi tiết cách tính % của đồng vị\(^{17} \text{O}\) và\(^{18} \text{O}\) từ nguyên tử khối trung bình 16,00447.

Đáp án D
%41K = 100 - 93,26 - 0,012 = 6,728%.
Khối lượng nguyên tử trung bình của K là:
MK = 39 x 0,9326 + 40 x 0,00012 + 41 x 0,06728 = 39,13468.
Khối lượng nguyên tử trung bình của Br là:
MBr = 79,92.
Thành phần phần trăm của 39K trong KBr là
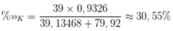

Gọi x,y lần lượt là phần trăm đồng vị của 12C và 13C
Ta có: \(\left\{{}\begin{matrix}x+y=100\\12.0,01x+13.0,01y=12,011\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=100-y\\0,12.\left(100-y\right)+0,13.y=12,011\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=98,9\%\\y=1,1\%\end{matrix}\right.\)

Đặt x nguyên tử khối của đồng vị còn lại
Ta có : \(\overline{M}=\dfrac{54,5.79+\left(100-54,5\right).x}{100}=79,91\)
\(\rightarrow x=81\)
Vậy nguyên tử khối của đồng vị còn lại : \(^{81}X\)

Bài 1:
Gọi x là số khối của đồng vị thứ 2, ta có:
\(\frac{107.56\%+x44\%}{100\%}=107,88\)
\(\Rightarrow x=109\)
Vậy số khối của đồng vị thứ 2 là 109
Nếu có 500 nguyên tử Ag thì số nguyên tử của đồng vị thứ 2 là: \(\frac{44\%.500}{100\%}=220\) (nguyên tử)
\(M_{Ag^{ }_2O}=\left(107,88.2\right)+16=231,76\)
\(\Rightarrow n=\frac{57,94}{231,76}=0,25\left(mol\right)\)
Xét trong 1 mol Ag2O có \(\begin{cases}2molAg\\1molO\end{cases}\)
\(\Rightarrow\) trong 0,25 mol Ag2O có 0,5 mol Ag
\(\Rightarrow\) trong 0,5 mol Ag có \(\frac{56\%.0,5}{100\%}=0.28\left(mol\right)\) đồng vị 107Ag
\(\Rightarrow m_{^{107}Ag}\) = 107 . 0,28 = 29,96 (gam)
Bài 2:
a) Gọi x, y lần lượt là % về số nguyên tử của 2 đồng vị 35Cl và 37Cl, ta có:
\(\begin{cases}x+y=100\\\frac{35x+37y}{100}=35,5\end{cases}\)\(\Leftrightarrow\)\(\begin{cases}x=75\\y=25\end{cases}\)
Vậy đồng vị 35Cl chiếm 75%; đồng vị 37Cl chiếm 25%
b) Tính % về gì vậy bạn?
c) \(M_{AlCl_3}\) = 27 + (35,5 .3) = 133,5
\(\Rightarrow n_{AlCl_3}\) = \(\frac{13,35}{133,5}=0,1\left(mol\right)\)
Xét trong 1 mol AlCl3 có \(\begin{cases}1molAl\\3molCl\end{cases}\)
=> trong 0,1 mol AlCl3 có 0,3 mol Cl
=> trong 0,3 mol Cl có \(\frac{75\%.0,3}{100\%}=0,225\left(mol\right)\) đồng vị 35Cl
=> Số nguyên tử 35Cl có trong 13,35g AlCl3 là:
0,225 . 6,02 . 1023 = 1,3545.1023 (nguyên tử)
1)Cách 1: nhẩm nhanh cho các bài có Z nhỏ, Z lớn vẫn có thể áp dụng nếu bạn gần như đã thuộc bảng tuần hoàn-để có thể suy ra đáp án :d) lấy 10/3 xấp xỉ 3,333 => lấy số gần nhất là 3 tương đương với Z của Nguyên tử cần tìm => Li (giải thích: tổng 3 hạt là E,N,P trong đó E P bằng nhau(, N thì lớn hơn hoặc bằng P, nên muốn tìm Z (Z = E =P) thì chia 3 ra (3 hạt), lấy số đó hoặc phần nguyên nếu lẻ), Z nhỏ thì NP không khác nhau nhiều, còn Z lớn ví dụ (Fe Z=26, N=30, tổng số hạt là 82 chia 3 ra thì là 27,333...không còn đúng nữa.!
Cách 2: cách chính quy dùng cho Kt trên lớp, kiếm điểm:D:
3≤ (2Z+N)/Z < 3,5 (*)=> 2,8...<Z<3,33... => Z=3 (Li) cách này áp dụng cho mọi bài tập dạng này. để hiểu rõ hơn vì sao có công thức (*) bạn nghiên cứu thêm bài tập 1.19 trong sách bài tập hóa lớp 10 trang 6.
2)Mtb= 109*44%+X*(100-44)%=107,88 => X=107

Nguyên tử khối trung bình A của nguyên tố bo trong tự nhiên :
![]()
Nguyên tử khối trung bình của nguyên tố bo : 10,8.