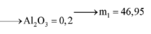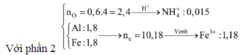Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A. 184,1 gam và 91,8 gam.
B. 84,9 gam và 91,8 gam.
C. 184,1 gam và 177,9 gam.
D. 84,9 gam và 86,1 gam.

Cho m gam hỗn hợp X gồm ( Fe , FeO , Fe2O3 ) có tỷ lệ khối lượng tương ứng là 7:18:40 .Hỗn hợp X tan vừa hết trong 500 ml H2SO4 loãng 0,68 M thu được dung dịch B và thoát ra V lít khí H2 ( đktc). Cho dung dịch B tác dụng NaOH dư lọc kết tủa nung khô trong không khí thu được 22,4 gam chất rắn. Giá trị của V là ?
A. 0,448
B. 0,896
C. 2,24
D. 1,12

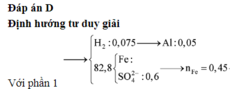
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D

Giải thích:
Phần 1:
nH2 = 0,075 => nAldư = 0,05
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
8x→ 3x →4x → 9x
Chất rắn không tan trong NaOH là Fe (9x mol). Với H2SO4 đặc nóng
=> Fe3+ (u) và Fe2+ (v)
Bảo toàn electron: 3u + 2v = 0,6 . 2
m muối = 400a/2 + 152b = 82,8
=> u = 0,3 và v = 0,15
=> 9x = u + v => x = 0,05
Vậy phần 1 chứa Al (0,05), Al2O3 (0,2) và Fe (0,45)
=> mPhần 1 = 46,95
=> mPhần 2 = mX - mPhần 1 = 187,8
=> mPhần 2 = 4mPhần 1
Vậy phần 2 chứa các chất có số mol gấp 4 phần 1.
Phần 2 chứa Al (0,2), Al2O3 (0,8) và Fe (1,8)
=> nO = 0,8 . 3 = 2,4
nH+ = 12,97 = 4nNO + 2nNO2 + 2nO + 10nNH4+
=> nNH4+ = 0,015
Dung dịch A chứa Fe3+ (a mol), Fe2+ (y mol) và các ion khác.
Bảo toàn Fe => a + b = 1,8
Bảo toàn electron => 3a + 2b + 0,2 . 3 = 1,25 . 3 + 1,51 + 0,015 . 8
=> a = 1,18 và b = 0,62
Đáp án D

nFe = nFeCl3 = 0,06 mol => nO (oxit ) = ( 4 – 0,06.56)/16 = 0,04 mol
Quy đổi 4 gam A thành Fe và O. Cho tác dụng với HNO3 :
Fe à Fe3+ + 3e O + 2e à O2-
0,06 0,18 0,08 0,04
N+5 + 3e àNO => V = 0,1/3.22,4 = 0,747 lit
0,1 0,1/3

N+5 +1e =>N+4
0,02 mol<=0,02 mol
2N+5 +2.4e =>2N+1
0,04 mol<=0,01 mol
ne nhận=ne nhường=0,06 mol
nNO3- tạo muối=ne nhận=0,06 mol
=>mNO3-=0,06.62=3,72g
mKL=5,04g=>m muối=m gốc KL+mNO3-=3,72+5,04=8,76g
nHNO3 =0,06+0,02+0,005.2=0,09 mol
=>CM dd HNO3=0,09/0,1=0,9M
Phương trình nhận electron:
N+5 + 8e → N2O
N+5 +1e→NO2
nNO tạo muối = nNO + 8nN2O = 0,02 + 8.0,005 = 0.02 + 0,04 = 0,06 mol
mNO tạo muối =0,06.62 = 3,72g
m =mKL+ mNO tạo muối = 5,04 + 3,72 = 8,76g
nHNO3 tham gia phản ứng = 2nNO + 10nN2O = 2.0,02 + 10.0,005= 0,09 mol
x =0.09:0,1=0,9M ==>> Đáp án thứ nhất