

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Gọi số p,e,n trong của M và X lần lượt là p1,e1,n1 , p2,e2,n2
=> 2(p1+e1+n1) + ( p2+e2+n2)=140
Mà số p=số e
=> 2(2p1 + n1) + ( 2p2 + n2) = 140 <=> (4p1+2p2) + (2n1+n2)=140 (I)
Lại có : (4p1+2p2)-(2n1+n2)=44 (II)
Từ (I) và (II ) => \(\left\{{}\begin{matrix}4p1+2p2=92\left(1\right)\\2n1+n2=48\end{matrix}\right.\)
Lại có : (p1 + n1) - (p2+n2)=23 (III)
(2p1 + n1 -1) - (2p2+n2+2) =31 (IV)
Từ (III) và (IV) => \(\left\{{}\begin{matrix}p1-p2=11\left(2\right)\\n1-n2=12\end{matrix}\right.\)
Từ (1) và (2) => \(\left\{{}\begin{matrix}p1=19\\p2=8\end{matrix}\right.\)
=> số e của M là 19 e
số e của X là 8 e
=> cấu hình e của M là : 1s22s22p63s23p64s1
cấu hình e của X là : 1s22s22p4

1. Điện tích tuyệt đối Điện tích tuyệt đối nghĩa là giá trị thực của điện tích mà từng hạt mang (tính theo coulomb hoặc theo đơn vị điện tích cơ bản e = 1,602 × 10⁻¹⁹ C). Proton: mang điện tích +e = +1,602 × 10⁻¹⁹ C Electron: mang điện tích –e = –1,602 × 10⁻¹⁹ C Neutron: không mang điện tích ⇒ 0 C 👉 Điện tích tuyệt đối của proton và electron là như nhau về độ lớn, khác dấu. --- 2. Điện tích tương đối Trong vật lý hạt nhân hay hóa học, người ta hay quy ước điện tích tương đối theo đơn vị e (đơn vị điện tích cơ bản). Proton: +1 Electron: –1 Neutron: 0 👉 Điện tích tương đối chỉ cho biết "so với e thì hạt đó bằng bao nhiêu". --- 3. Điện tích hạt nhân (nếu mày hỏi thêm về toàn bộ hạt nhân) Nếu hạt nhân có Z proton và N neutron thì: Điện tích tuyệt đối của hạt nhân = Z × e (Coulomb) Điện tích tương đối của hạt nhân = Z (đơn vị e) Còn neutron không góp phần vào điện tích hạt nhân, chỉ góp khối lượng. ---
Lưu ý: Proton mang điện dương, electron mang điện âm, neutron trung hòa.

Cái nguyên tử X mình làm ko ra bạn xem lại đề cái 53,125 nếu là 53,125% thì bạn giải ra đươc p = 16 và n = 17 đó là lưu huỳnh ( ra nghiệm đẹp mình nghĩ là đúng )
Ta có 2p + n = 8 và n = 52,63/100 . ( p + n ) từ hệ trên bạn giải ra p = 9 và n = 10 đó là Flo

Xét hiệu độ âm điện các nguyên tố trong phân tử, ta có:
\(PH_3\): \(2,20-2,19=0,01< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(H_2S\): \(2,58-2,20=0,38< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(NH_3\): \(3,04-2,20=0,84>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(BeCl_2\): \(3,16-1,57=1,59>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(HF:\) \(3,98-2,20=1,78>1,7\text{ }\Rightarrow\) Liên kết ion
\(BF_3:\) \(3,98-2,04=1,94>1,7\text{ }\Rightarrow\) Liên kết ion
\(LiF:\) \(3,98-0,98=3,00>1,7\text{ }\Rightarrow\) Liên kết ion
\(ClO_2\): \(3,44-3,16=0,28< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.

a) Từ kí hiệu ta thấy nguyên tử Ar có số đơn vị điện tích hạt nhân là 18; vậy Ar có 18 prôtn, 18 electron và có 40-18= 22 nơtron
b) Lớp vỏ electron của nguyên tử có 18e được phân bố như sau : 1s2 2s2 2p6 3s2 3p6.

Đáp án B
Giả sử số hiệu nguyên tử của X, Y lần lượt là ZX, ZY
Ta có hpt 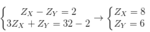
ZZ = 17 - ZX - ZY = 17 - 8 - 6 = 3.
Cấu hình electron của X, Y, Z là
8X: 1s22s22s4 → X thuộc chu kì 2, nhóm VIA.
6Y: 1s22s22p2 → Y thuộc chu kì 2, nhóm IVA.
3Z: 1s22s1 → Z thuộc chu kì 2, nhóm IA.
→ Chọn B.

Xét hiệu độ âm điện :
\(P_2O_5\): \(3,44-2,19=1,25>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(HAt\): \(2,20-2,2=0< 0,4\text{ }\Rightarrow\)Liên kết cộng hoá trị không cực.
\(C_3O_2\): \(3,44-2,55=0,89>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(CsF\): \(3,98-0,79=3,19>1,7\text{ }\Rightarrow\) Liên kết ion.
\(NaCl\): \(3,16-0,93=2,23>1,7\text{ }\Rightarrow\) Liên kết ion.
\(CaO\): \(3,44-1,00=2,44>1,7\text{ }\Rightarrow\) Liên kết ion.
\(PN\): \(3,04-2,19=0,85>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(ClF_3\): \(3,98-3,16=0,82>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.