
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


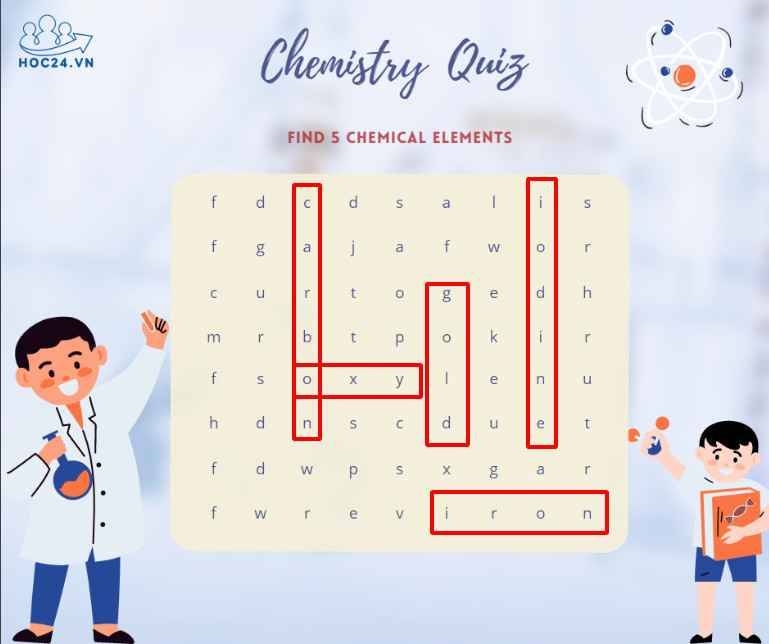
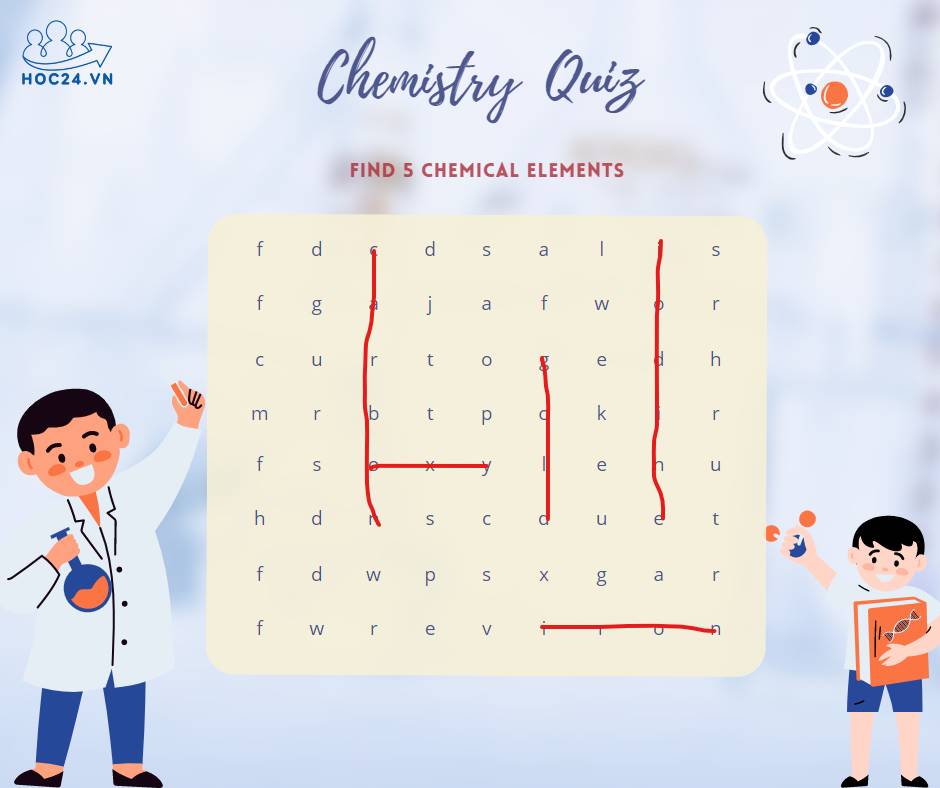
*cái oxy em k chắc á cô:<< em tìm được mấy nguyên tố này th ạ:<.

Đề bài cho hỗn hợp X gồm hai khí là methane (CH4) và ethylene (C2H4). Hỗn hợp này có tỉ khối so với hydrogen (H2) bằng 10.
- Bước 1: Tính khối lượng mol trung bình của hỗn hợp X (MX)
Tỉ khối của hỗn hợp X so với hydrogen được tính bằng công thức: dX/H2=MH2MX.
Trong đó, MH2=2 g/mol.
Ta có: 10=2MX⇒MX=10×2=20 g/mol.
- Bước 2: Gọi thành phần phần trăm thể tích của từng khí trong hỗn hợp
Giả sử trong 1 mol hỗn hợp X, số mol của CH4 là x và số mol của C2H4 là y.
Ta có: x+y=1 (1)
Khối lượng mol trung bình của hỗn hợp X được tính bằng công thức: MX=nCH4+nC2H4nCH4⋅MCH4+nC2H4⋅MC2H4.
MCH4=12+4=16 g/mol.
MC2H4=12×2+4=28 g/mol.
Thay vào công thức ta có: 20=x+yx⋅16+y⋅28=116x+28y (2)
Từ (1) và (2) ta có hệ phương trình:
x+y=1
16x+28y=20
Giải hệ phương trình này, ta được: x=32 và y=31.
Điều này có nghĩa là trong hỗn hợp X, số mol của CH4 chiếm 32 và số mol của C2H4 chiếm 31.
- Bước 3: Tính tổng số mol của hỗn hợp X
Thể tích của hỗn hợp X ở điều kiện tiêu chuẩn (đktc) là 3,7185 lít.
Số mol của hỗn hợp X là: nX=24.79V=24.793.7185=0.15 mol.
(Lưu ý: Nếu đề bài cho ở điều kiện tiêu chuẩn cũ (0 độ C, 1 atm) thì V = 22.4, nhưng theo quy ước quốc tế mới, 1 bar và 25 độ C thì V = 24.79. Đề bài không nói rõ nên ta chọn chuẩn mới là 24.79).
- Bước 4: Tính số mol C2H4 trong hỗn hợp X
Từ kết quả ở bước 2, ta biết số mol C2H4 chiếm 31 tổng số mol.
nC2H4=nX×y=0.15×31=0.05 mol.
- Bước 5: Tính số mol Br2 đã phản ứng
Khi hỗn hợp X cho qua dung dịch Br2 dư, chỉ có ethylene (C2H4) phản ứng vì nó có liên kết đôi (C=C). Methane (CH4) là ankan nên không phản ứng với Br2.
Phương trình phản ứng:
C2H4+Br2→C2H4Br2
Theo phương trình, tỉ lệ mol là 1:1, vậy:
nBr2=nC2H4=0.05 mol.
Kết luận
Số mol Br2 đã tham gia phản ứng là 0,05 mol.


\(n_{H_2}=\dfrac{15,68}{22,4}=0,7mol\)
-Gọi số mol Al là x, số mol Mg là y
2Al+6HCl\(\rightarrow\)2AlCl3+H2
x\(\rightarrow\).............................\(\dfrac{3x}{2}\)
Mg+2HCl\(\rightarrow\)MgCl2+H2
y\(\rightarrow\).............................y
- Ta có hệ: \(\left\{{}\begin{matrix}27x+24y=15\\\dfrac{3x}{2}+y=0,7\end{matrix}\right.\)
Giải ra x=0,2 và y=0,4
mAl=27.0,2=5,4gam
mMg=24.0,4=9,6gam
%Al=\(\dfrac{5,4}{15}.100\%=36\%\)
%Mg=100%-36%=64%


nNO = 0.035mol
-hỗn hợp B gồm Fe và Fe3O4 dư
-muối trong dd Z là Fe(NO3)3 với số mol =\(\dfrac{18,15}{242}\) = 0.075mol
-toàn bộ Fe trong B( chính bằng Fe trong oxit ban đầu) đều đi vào muối \(\rightarrow\) nFe ban đầu = 0.075mol \(\rightarrow\) mFe ban đầu = 4.2g
\(\rightarrow\) mO trong oxit = 5,8-4,2=1.6g \(\rightarrow\) nO = 0.1mol
\(\rightarrow\)FexOy: \(\dfrac{x}{y}=\dfrac{0,075}{0,1}=\dfrac{3}{4}\)\(\rightarrow\)Fe3O4
Fe+ 2HCl\(\rightarrow\)FeCl2+H2
\(n_{Fe}=n_{H_2}=\dfrac{0,672}{22,4}=0,03mol\)\(\rightarrow\)mFe=0,03.56=1,68 g
\(n_{NO}=\dfrac{0,784}{22,4}=0,035mol\)
Fe+4HNO3\(\rightarrow\)Fe(NO3)3+NO+2H2O
3Fe3O4+28HNO3\(\rightarrow\)9Fe(NO3)3+NO+14H2O
\(n_{NO}=n_{Fe}+n_{Fe_3O_4}\)
\(\rightarrow\)\(n_{Fe_3O_4}=0,035-0,03=0,05mol\)
\(m_{Fe_3O_4}=0,05.232=11,6gam\)
%Fe=\(\dfrac{1,68.100}{1,68+11,6}\approx12,65\%\)
\(\%Fe_3O_4=100\%-12,65\%=87,35\%\)
4CO+Fe3O4\(\rightarrow\)4CO2+3Fe
\(n_{CO\left(pu\right)}=n_{CO_2\left(tt\right)}=4n_{Fe}=4.0,03=0,12mol\)
-Gọi số mol CO ban đầu là x.Hỗn hợp A có: 0,12 mol CO2 và x-0,12 mol CO
\(\rightarrow\)nA=0,12+x-0,12=x mol
\(\overline{M_A}=17,2.2=34,4\)
\(\rightarrow\)\(\dfrac{44.0,12+28\left(x-0,12\right)}{x}=34,4\)
\(\rightarrow\)44.0,12+28x-28.0,12=34,4x
\(\rightarrow\)6,4x=1,92\(\rightarrow\)x=0,3 mol
\(V_{CO}=0,3.22,4=6,72l\)
Trong A có: 0,12 mol CO2 và 0,3-0,12=0,18 mol CO
%CO2=\(\dfrac{0,12.100}{0,12+0,18}=40\%\)
%CO=60%


Câu 3:
N2+O2\(\overset{t^0}{\rightarrow}\)2NO
4NO+3O2+2H2O\(\rightarrow\)4HNO3
NO3- : làm tăng lượng phân đạm cho cây!










 mn giúp e những câu còn lại ạ :)
mn giúp e những câu còn lại ạ :)










 Giúp mình giải vài câu thực tế Hoá nha..
Giúp mình giải vài câu thực tế Hoá nha..
Z không tác dụng với dd HCl => Zn hết
Dung dịch NaOH + dd Y -> 8,82 gam kết tủa
=> Trong dd vẫn còn muối Cu(NO3)2 dư
\(n_{Zn}=\dfrac{10,4}{65}=0,16\left(mol\right)\)
PTHH:
Zn + 2AgNO3 ---> Zn(NO3)2 + 2Ag↓ (1)
Zn + Cu(NO3)2 ---> Zn(NO3)2 + Cu↓ (2)
Zn(NO3)2 + 2NaOH ---> Zn(OH)2↓ + 2NaNO3 (3)
Cu(NO3)2 + 2NaOH ---> Cu(OH)2↓ + 2NaNO3 (4)
2Ag(NO3)2 + 2NaOH ---> Ag2O↓ + H2O + 2NaNO3 (5)
Xét 2 trường hợp:
- Trường hợp 1: AgNO3 dư
Theo PT (1): nAg = 2nZn = 0,32(mol)
=> mAg = 0,32.108 = 34,56(g) > 17,84 (g) (vô lý)
=> Loại
- Trường hợp 2: AgNO3 hết
Gọi \(\left\{{}\begin{matrix}n_{AgNO_3}=a\left(mol\right)\\n_{Cu\left(NO_3\right)_2\left(pư\right)}=b\left(mol\right)\\\end{matrix}\right.\)
BTNT Ag: \(n_{Ag}=n_{AgNO_3}=a\left(mol\right)\)
BTNT Cu: \(n_{Cu}=n_{Cu\left(NO_3\right)_2\left(pư\right)}=b\left(mol\right)\)
=> 108a + 64b = 17,84 (*)
Theo PT (1),(2): \(n_{Zn}=\dfrac{1}{2}n_{Ag}+n_{Cu}\)
=> 0,5a + b = 0,16 (**)
(*),(**) => a = 0,1; b = 0,11
\(n_{Cu\left(OH\right)_2}=\dfrac{8,82}{98}=0,09\left(mol\right)\)
BTNT Cu: \(n_{Cu\left(NO_3\right)_2\left(dư\right)}=n_{Cu\left(OH\right)_2}=0,09\left(mol\right)\)
Vậy dd ban đầu có: \(\left\{{}\begin{matrix}n_{AgNO_3}=0,1\left(mol\right)\\n_{Cu\left(NO_3\right)_2}=0,11+0,09=0,2\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(AgNO_3\right)}=\dfrac{0,1}{0,4}=0,25M\\C_{M\left(Cu\left(NO_3\right)_2\right)}=\dfrac{0,2}{0,4}=0,5M\end{matrix}\right.\)
ũmg cho em bái a Dagg Dzan Hiuuu làm sư phụ được khong ạ?:>