Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TN1: Gọi (nAl; nZn; nFe) = (a; b; c)
=>27a + 65b + 56c = 20,4 (1)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a----------------------->1,5a
Zn + 2HCl --> ZnCl2 + H2
b--------------------->b
Fe + 2HCl --> FeCl2 + H2
c----------------------->c
=> \(1,5a+b+c=0,45\) (2)
TN2: Gọi (nAl; nZn; nFe) = (ak; bk; ck)
=> ak + bk + ck = 0,2 (3)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275\left(mol\right)\)
PTHH: 2Al + 3Cl2 --to--> 2AlCl3
ak-->1,5ak
Zn + Cl2 -to-> ZnCl2
bk--->bk
2Fe + 3Cl2 --to--> 2FeCl3
ck--->1,5ck
=> 1,5ak + bk + 1,5ck = 0,275 (4)
(1)(2)(3)(4) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,1\left(mol\right)\\c=0,2\left(mol\right)\end{matrix}\right.\)
=> \(\%Fe=\dfrac{0,2.56}{20,4}.100\%=54,9\%\)

Đáp án D
Xét trường hợp 20,4 gam A tác dụng với dung dịch HCl dư:
Gọi số mol các chất là Al: a mol; Zn: b mol; Fe: c mol
Ta có:

Các quá trình nhường, nhận electron:
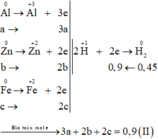
Xét trường hợp 0,2 mol A tác dụng với Cl2:
Gọi số mol các chất là Al: ka mol; Zn: kb mol; Fe: kc mol
Ta có:
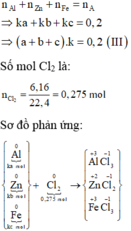
Các quá trình nhường, nhận electron:
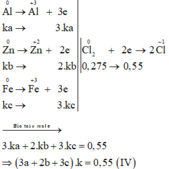
Lấy (IV) chia (III) vế với vế ta được:


Ta có: \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
BT e, có: x.nM = 4nO2 + 2nH2
\(\Rightarrow n_M=\dfrac{1,5}{x}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{13,5}{\dfrac{1,5}{x}}=9x\left(g/mol\right)\)
Với x = 3 thì MM = 27 (g/mol)
→ M là nhôm (Al)
m = mKL + mO2 = 13,5 + 0,3.32 = 23,1 (g)

Đáp án A
Các phương trình phản ứng :

Tính toán:
Gọi số mol các chất trong X là Fe: a mol; C: 2a mol. Ta có:

Sơ đồ phản ứng :
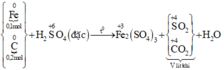
Các quá trình nhường, nhận electron:


Đặt \(n_{Fe}=a\left(mol\right)\) \(\Rightarrow n_{Al}=2a\left(mol\right)\)
Ta có: \(56a+27\cdot2a=11\) \(\Leftrightarrow a=0,1\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(3n_{Al}+2n_{Fe}=2n_{H_2}\)
\(\Rightarrow n_{H_2}=0,4\left(mol\right)\) \(\Rightarrow V_{H_2}=0,4\cdot22,4=8,96\left(l\right)\)

Theo gt ta có: $n_{H_2SO_4}=0,2(mol);n_{HCl}=0,15(mol);n_{H_2}=0,25(mol)$
a, Bảo toàn H ta có: $n_{H^+/pu}=0,5(mol)< 0,55(mol)$
Do đó axit còn dư
b, Ta có: $n_{Ba(OH)_2}=0,18(mol);n_{NaOH}=0,3(mol)$
Gọi số mol Mg và Al lần lượt là a;b(mol)
$\Rightarrow 24a+27b=5,1$
Bảo toàn e ta có: $2a+3b=0,5$
Giải hệ ta được $a=b=0,1$
Lượng $OH^-$ tạo kết tủa là $0,18.2+0,3-0,05=0,61(mol)$
Kết tủa gồm 0,18 mol $BaSO_4$; 0,1 mol $Mg(OH)_2$ (Do Al(OH)3 tạo ra bị hòa tan hết)
$\Rightarrow m_{kt}=47,74(g)$





