Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có : \(n_{NaOH}=n_{HCl}\Leftrightarrow C_{MNaOH}.V_{NaOH}=C_{MHCl}.V_{HCl}\)
\(\Rightarrow C_{MNaOH}=\dfrac{C_{MHCl}.V_{HCl}}{V_{NaOH}}=\dfrac{0,1.0,01}{0,0102}\simeq0,1l=100ml\)

\(n_{NaOH}=0,02.0,1=0,002\left(mol\right)\\ HCl+NaOH\rightarrow NaCl+H_2O\\ \Rightarrow n_{HCl}=n_{NaOH}=0,002\left(mol\right)\\ \Rightarrow\left[HCl\right]=\dfrac{0,002}{0,01}=0,2M\)

Trong 50 ml dd có 1 gam acid.
Ta có: \(n_{NaOH}=0,0327.0,5=0,01635\left(mol\right)\)
\(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
\(\Rightarrow n_{CH_3COOH\left(trong50ml\right)}=n_{NaOH}=0,01635\left(mol\right)\)
\(\Rightarrow m_{CH_3COOH\left(trong50ml\right)}=0,01635.60=0,981\left(g\right)\)
\(\Rightarrow\%m_{CH_3COOH}=\dfrac{0,981}{1}.100\%=98,1\%\)

1,
V1, N1 là thể tích, nồng độ of HCl
V2, N2 là thể tích, nồng độ of Na2CO3
Sử dụng công thức V1 N1 = V2 N2
==> N2 = 0.42 (N)
--> C = 0.21 (M)
--> m =0.6678 g. Vậy hàm lượng Na2CO3 là 0.6678g trong 2g ngậm nc.
2,
Pha dung dịch 0.1M: cần 10.6g Na2CO3 tinh khiết. Trong 2g muối thì có 0.6678g Na2CO3 --> cần dùng 35.3934g muối trên --> định mức 1L (1000ml)

Đáp án B
• 0,1a mol NaOH + 0,04 mol AlCl3 → ↓ Al(OH)3
Nung ↓ → 0,015 mol Al2O3
→ nAl(OH)3 = 0,03 mol.
• TH1: NaOH hết
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
nNaOH = 0,03 × 3 = 0,09 mol
→ CMNaOH = 0,09 : 0,1 = 0,9 M.
• TH2: NaOH dư
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl (*)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (**)
Theo (*) nNaOH = 0,04 × 3 = 0,12 mol; nAl(OH)3 = 0,04 mol.
Theo (**) nAl(OH)3 phản ứng = 0,04 - 0,03 = 0,01 mol
→ nNaOH = 0,01 mol
→ ∑nNaOH = 0,12 + 0,01 = 0,13 mol
→ CMNaOH = 0,13 : 0,1 = 1,3 M

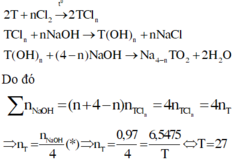

\(M = 2 \times 12,011 + 6 \times 1,008 + 6 \times 16,00 \approx 126,07 \&\text{nbsp}; \left(\text{g} \backslash\text{cdotp} \text{mol}\right)^{- 1} .\)
\(n_{\text{acid}} = \frac{1,26}{126,07} \approx 0,0099944 \&\text{nbsp};\text{mol} .\)
\(C_{\text{acid}} = \frac{0,0099944}{0,100} = 0,099944 \&\text{nbsp};\text{M} .\)
\(n_{\text{m} \overset{\sim}{\hat{\text{a}}} \text{u}} = 0,099944 \times 0,010 = 0,00099944 \&\text{nbsp};\text{mol} .\)
\(n_{\text{NaOH}} = 2 \times 0,00099944 = 0,00199888 \&\text{nbsp};\text{mol} .\)
\(C_{\text{NaOH}} = \frac{0,00199888}{0,0175} \approx 0,11422 \&\text{nbsp};\text{M} .\)
Kết luận: nồng độ dung dịch NaOH \(\approx 0,114 \&\text{nbsp}; \mathbf{M}\) (≈0,1142 M nếu giữ 4 chữ số thập phân).
cho mk 1 like nhé