Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(n_{HCl}=\dfrac{7,3}{36,5}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{0,2}{2}\) > \(\dfrac{0,2}{6}\) ( mol )
1/15 0,2 1/15 0,1 ( mol )
\(m_{AlCl_3}=\dfrac{1}{15}.13,5=8,9g\)
\(m_{H_2}=0,1.2=0,2g\)
\(m_{Al\left(dư\right)}=\left(0,2-\dfrac{1}{15}\right).27=3,6g\)

a. 2Al + 3 \(CuSO_4\)→ 1 \(Al_2\left(SO_4\right)_3+3Cu\)
0.45 0,3375 (mol)
⇔0,225.2 0,1125.3 (mol)
0,3375 -----→ \(\dfrac{0,3375.1}{3}\)=0,1125 (mol)
(lấy số mol lớn - số mol bé ➙ số mol dư)
b. \(n_{Al}\)= \(\dfrac{12,15}{27}\)=0,45 (mol)
\(n_{CuSO_4}\)= \(\dfrac{54}{64+32+16.4}\)=0,3375(mol)
➝ \(n_{Al}\)dư= 0,1125 (mol)
⇒\(m_{Al_{dư}}\)= 0,1125.27=3.0375(gam)
⇒\(m_{Al_2\left(SO_4\right)_3}\)= 0,1125. \(\left[27.2+2\left(32+16.4\right)\right]\)=27,675(gam)

nAl=0,2(mol)
mHCl=500.10%=50(g) => nHCl=50/36,5=100/73(mol)
PTHH: 2 Al + 6 HCl -> 2 AlCl3 + 3 H2
Vì: 0,2/2 < 100/73:6
=> Al hết, HCl dư, tính theo nAl
a) nH2=3/2. 0,2=0,3(mol) => V(H2,đktc)=0,3.22,4=6,72(l)
b) mHCl(tham gia p.ứ)= 6/2. 0,2 . 36,5= 21,9(g)
c) mddsau= 5,4+500-0,3.2=504,8(g)
mAlCl3=0,2. 133,5= 26,7(g)
mHCl(DƯ)= 50 -21,9=28,1(g)
C%ddAlCl3= (26,7/504,8).100=5,289%
C%ddHCl(dư)= (28,1/504,8).100=5,567%

\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,\text {Bảo toàn KL: }m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\\ \Rightarrow m_{ZnCl_2}=6,5+7,3-0,2=13,6(g)\)

1. PTHH: 4Al + 3O2 ---> 2Al2O3
1,2 mol 0,9 mol 0,6 mol
+ Số mol của Al:
nAl = m/M = 32,4/27 = 1,2 (mol)
+ Số mol của O2:
nO2 = V/22,4 = 21,504/22,4 = 0,96 (mol)
a. + Số mol của Al2O3:
nAl2O3 = 1,2.2/4 = 0,6 (mol)
+ Khối lượng của Al2O3:
mAl2O3 = n.M = 0,6.102 = 61,2 (g)
Vậy: khối lượng của Al2O3 là 61,2 g
b. Tỉ lệ: Al O2
nAl/4 nO2/3
1,2/4 0,96/3
0,3 < 0,32
=> O2 dư; Al hết
+ Số mol phản ứng của O2:
nO2pư = 1,2.3/4 = 0,9 (mol)
+ Số mol dư của O2:
nO2dư = nO2 - nO2pư = 0,96 - 0,9 = 0,06 (mol)
+ Khối lượng dư của O2:
mO2dư = nO2dư . MO2 = 0,06 . 32 = 1,92 (g)
Vậy: chất còn dư trong phản ứng là O2 và khối lượng dư là 1,92 g
Note: có gì không rõ trong bài làm thì hỏi mình nha
Câu 2 và 4 bạn kiểm tra lại đề nhé, vì không có chất tạo thành thì sao tính được

\(\left(1\right).4Al+3O_2-^{t^o}\rightarrow2Al_2O_3\\ \left(2\right).m_{Al}+m_{O_2}=m_{Al_2O_3}\\ \left(3\right).m_{O_2}=m_{Al_2O_3}-m_{Al}=10,2-5,4=4,8\left(g\right)\)

\(n_{Al}=\dfrac{4,5}{27}=\dfrac{1}{6}mol\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,1 0,05 0,05 0,15 ( mol )
=> Al dư
\(m_{Al\left(dư\right)}=\left(\dfrac{1}{6}-0,1\right).27=1,8g\)
\(m_{Al_2\left(SO_4\right)_3}=0,05.342=17,1g\)
\(m_{H_2SO_4}=0,15.98=14,7g\)

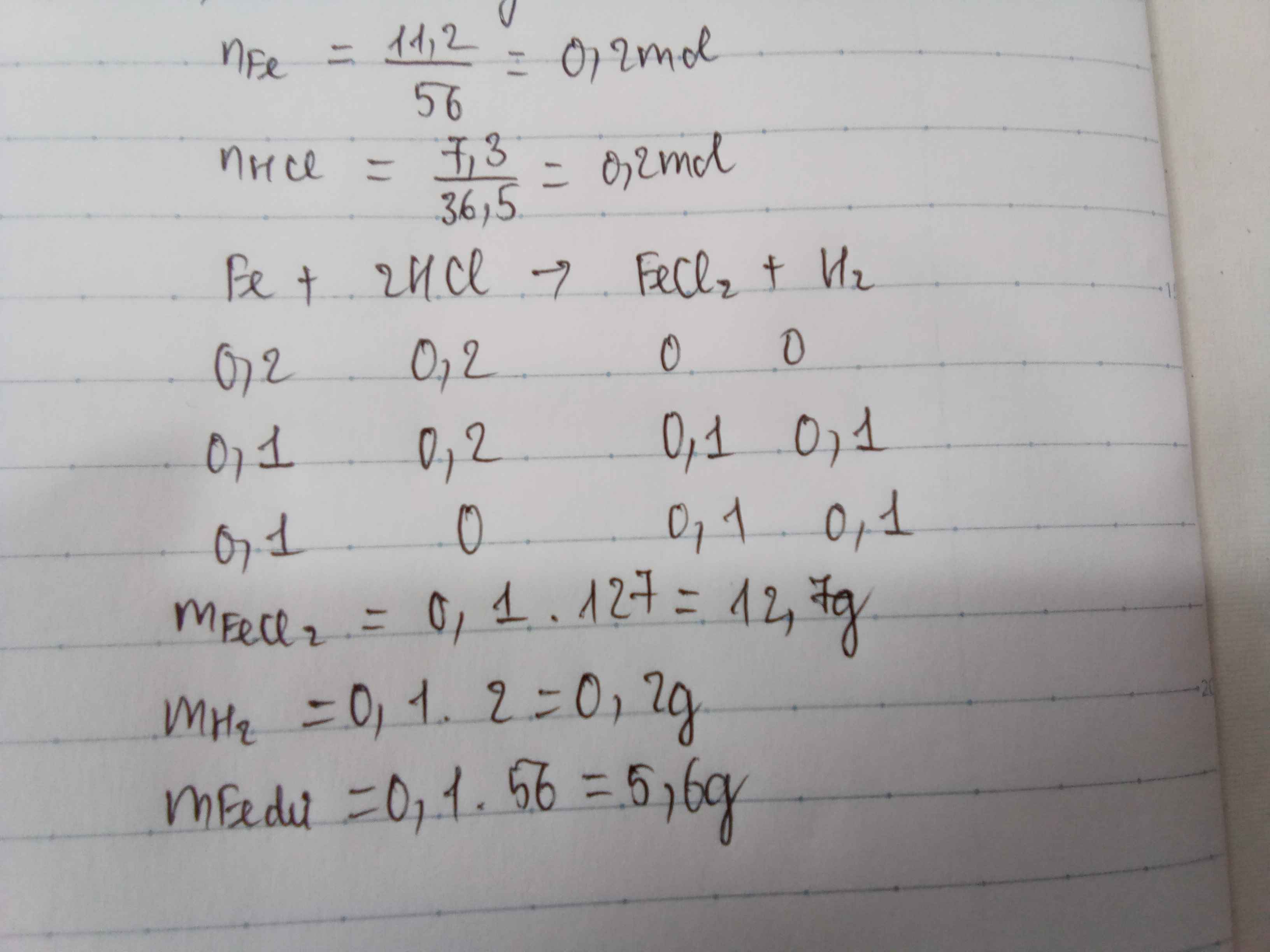
2Al+6Hcl->2AlCl3+3H2
1\15-0,2------1\15-----0,1 mol
n Al=0,2 mol
n HCl=0,2 mol
=>al dư
=>m AlCl3=\(\dfrac{1}{15}133,5\)=8,9g
=>m Aldư=\(\dfrac{2}{15}\).27=3,6g