
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


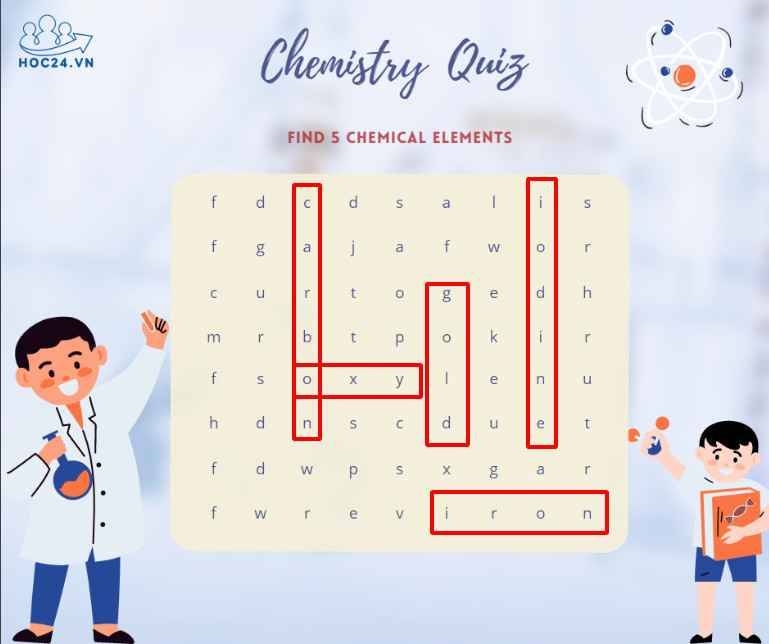
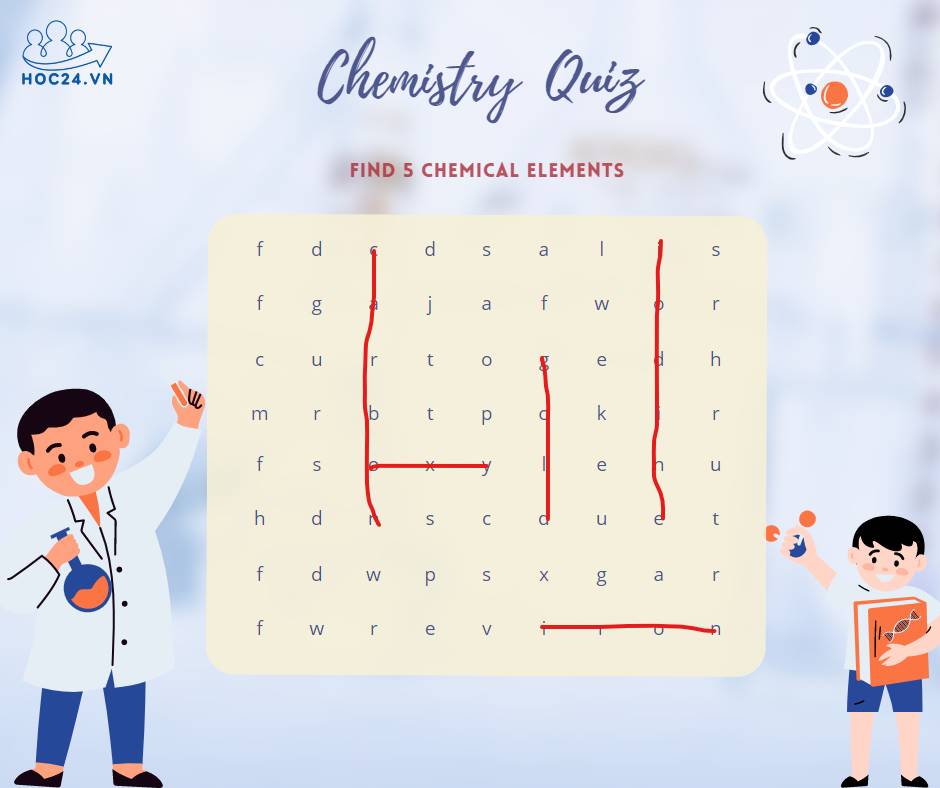
*cái oxy em k chắc á cô:<< em tìm được mấy nguyên tố này th ạ:<.

Đề bài cho hỗn hợp X gồm hai khí là methane (CH4) và ethylene (C2H4). Hỗn hợp này có tỉ khối so với hydrogen (H2) bằng 10.
- Bước 1: Tính khối lượng mol trung bình của hỗn hợp X (MX)
Tỉ khối của hỗn hợp X so với hydrogen được tính bằng công thức: dX/H2=MH2MX.
Trong đó, MH2=2 g/mol.
Ta có: 10=2MX⇒MX=10×2=20 g/mol.
- Bước 2: Gọi thành phần phần trăm thể tích của từng khí trong hỗn hợp
Giả sử trong 1 mol hỗn hợp X, số mol của CH4 là x và số mol của C2H4 là y.
Ta có: x+y=1 (1)
Khối lượng mol trung bình của hỗn hợp X được tính bằng công thức: MX=nCH4+nC2H4nCH4⋅MCH4+nC2H4⋅MC2H4.
MCH4=12+4=16 g/mol.
MC2H4=12×2+4=28 g/mol.
Thay vào công thức ta có: 20=x+yx⋅16+y⋅28=116x+28y (2)
Từ (1) và (2) ta có hệ phương trình:
x+y=1
16x+28y=20
Giải hệ phương trình này, ta được: x=32 và y=31.
Điều này có nghĩa là trong hỗn hợp X, số mol của CH4 chiếm 32 và số mol của C2H4 chiếm 31.
- Bước 3: Tính tổng số mol của hỗn hợp X
Thể tích của hỗn hợp X ở điều kiện tiêu chuẩn (đktc) là 3,7185 lít.
Số mol của hỗn hợp X là: nX=24.79V=24.793.7185=0.15 mol.
(Lưu ý: Nếu đề bài cho ở điều kiện tiêu chuẩn cũ (0 độ C, 1 atm) thì V = 22.4, nhưng theo quy ước quốc tế mới, 1 bar và 25 độ C thì V = 24.79. Đề bài không nói rõ nên ta chọn chuẩn mới là 24.79).
- Bước 4: Tính số mol C2H4 trong hỗn hợp X
Từ kết quả ở bước 2, ta biết số mol C2H4 chiếm 31 tổng số mol.
nC2H4=nX×y=0.15×31=0.05 mol.
- Bước 5: Tính số mol Br2 đã phản ứng
Khi hỗn hợp X cho qua dung dịch Br2 dư, chỉ có ethylene (C2H4) phản ứng vì nó có liên kết đôi (C=C). Methane (CH4) là ankan nên không phản ứng với Br2.
Phương trình phản ứng:
C2H4+Br2→C2H4Br2
Theo phương trình, tỉ lệ mol là 1:1, vậy:
nBr2=nC2H4=0.05 mol.
Kết luận
Số mol Br2 đã tham gia phản ứng là 0,05 mol.



Câu 3:
N2+O2\(\overset{t^0}{\rightarrow}\)2NO
4NO+3O2+2H2O\(\rightarrow\)4HNO3
NO3- : làm tăng lượng phân đạm cho cây!

a;Zn + 2HCl\(\rightarrow\)ZnCl2+H2
Zn+ H2SO4\(\rightarrow\)ZnSO4+H2
b;TN1:
\(\sum n_{H_2}=0,1+0,1=0,2\left(mol\right)\)
VH2=22,4.0,2=4,48(lít)
TN2:
\(\sum n_{H_2}=0,1+0,05=0,15\left(mol\right)\)
VH2=22,4.0,15=3,36(lít)
Vậy ở TN1 sinh ra nhiều H2 hơn

1. a) Tên gọi của axit:
HNO3: axit nitric
HCl: axit clohidric
H2CO3: axit cacbonic
H2S: axit sunfuhidric
H2SO4: axit sunfuric
H2SO3: axit sunfurơ
Axit mạnh: HCl, HNO3, H2SO4...
Axit yếu: H2S, H2CO3...
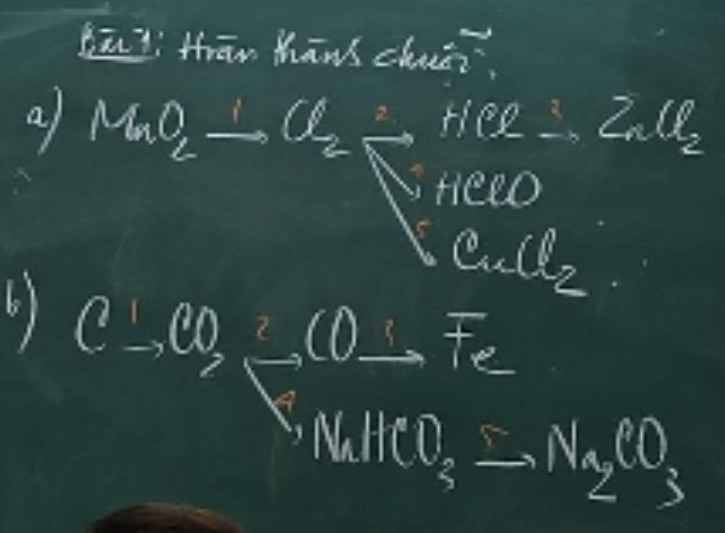




 mn giúp e những câu còn lại ạ :)
mn giúp e những câu còn lại ạ :)










 Giúp mình giải vài câu thực tế Hoá nha..
Giúp mình giải vài câu thực tế Hoá nha..





 Bài 5.5 ạ
Bài 5.5 ạ
 Giúp hộ mình nha !!!
Giúp hộ mình nha !!! Cảm ơn bạn !!!
Cảm ơn bạn !!!
a, (1) \(MnO_2+4HCl\underrightarrow{t^o}MnCl_2+Cl_2+2H_2O\)
(2) \(Cl_2+H_2\rightarrow2HCl\)
(3) \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
(4) \(Cl_2+H_2O⇌HCl+HClO\)
(5) \(Cu+Cl_2\underrightarrow{t^o}CuCl_2\)
b, (1) \(C+O_2\underrightarrow{t^o}CO_2\)
(2) \(CO_2+C\underrightarrow{t^o}2CO\)
(3) \(3CO+Fe_2O_3\underrightarrow{t^o}2Fe+3CO_2\)
(4) \(CO_2+NaOH\rightarrow NaHCO_3+H_2O\)
(5) \(NaHCO_3+NaOH\rightarrow Na_2CO_3+H_2O\)
a)
\(\left(1\right)MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(\left(2\right)Cl_2+H_2O\rightarrow HCl+HClO\)
\(\left(3\right)Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(\left(4\right)Cl_2+H_2O\rightarrow HCl+HClO\)
\(\left(5\right)Cu+Cl_2\rightarrow CuCl_2\)
b)
\(\left(1\right)C+O_2\rightarrow CO_2\)
\(\left(2\right)CO_2+C\rightarrow2CO\)
\(\left(3\right)Fe_3O_4+4CO\rightarrow3Fe+CO_2\)
\(\left(4\right)CO_2+NaOH\rightarrow NaHCO_3\)
\(\left(5\right)NaHCO_3+NaOH\rightarrow Na_2CO_3+H_2O\)