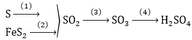Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2SO4=2/98=1/49 (mol)
\(S\rightarrow SO_2\rightarrow SO_3\rightarrow H_2SO_4\)
\(\frac{1}{49}\) \(\frac{1}{49}\)
mS=\(\frac{1}{49}.32=\frac{32}{49}\)
m S (thực có) = \(\frac{32}{49}.\frac{100}{80}=\frac{40}{49}\)
mquặng S=\(\frac{40}{49}.\frac{100}{60}=1,36\left(tấn\right)\)

1. mH2SO4=98g
C%=98%-3,405%=94,595%
=>mdd sau=mH2SO4/0,94595=103,6g
=>mH2O=103,6-100=3,6
=>nH2O=0,2
=>nO trog oxit=nH2O =0,2
(giai thich: cu 1 mol H2 pu thi lay di 1 mol O trog oxit)
nFe=nH2=0,15
=>nFe:nO=0,15:0,2=3:4
=>Fe3O4.
2. nNa2SO3=0,1
=>nSO2=0,1
nFe2(SO4)3=0,3
vi la hoa 9 nen bat buoc phai viet pthh:
2FexOy+(6x-2y)H2SO4=xFe2(SO4)3+(3x-2y)S...
ti le: 0,3/x=0,1/(3x-2y)
=>x=9x-6y
=>x:y=3:4
=>Fe3O4

- Khi cho dd BaCl2 vào dd A:
BaCl2 + Na2SO4 \(\rightarrow\) BaSO4\(\downarrow\) + 2NaCl (1)
BaCl2 + K2SO4 \(\rightarrow\) BaSO4\(\downarrow\) + 2KCl (2)
- Khi cho dd H2SO4 vào nước lọc thấy xuất hiện kết tủa, chứng tỏ trong nước lọc còn chứa BaCl2 (dư) và tham gia phản ứng hết với H2SO4.
BaCl2 + H2SO4 \(\rightarrow\) BaSO4\(\downarrow\)+ 2HCl (3)
- Khối lượng BaCl2 cho vào dung dịch A là:
\(m_{BaCl_2}=\frac{1664}{100}.10=166,4\left(g\right)\rightarrow n_{BaCl_2}=\frac{166,4}{208}=0,8\left(mol\right)\)
- Số mol BaCl2 tham gia phản ứng (3) là:
\(n_{BaCl_2\left(3\right)}=n_{BaSO_4\left(3\right)}=\frac{46,6}{233}=0,2mol\)
- Suy ra tổng số mol Na2SO4 và K2SO4 = số mol BaCl2 tham gia phản ứng (1) và (2) và bằng: \(n_{\left(Na_2SO_4+K_2SO_4\right)}=n_{BaCl_2\left(1+2\right)}=0,8-0,2=0,6mol\)
- Vì số mol Na2SO4 và K2SO4 trong hỗn hợp trộn với nhau theo tỉ lệ 1:2 nên ta có:
\(n_{Na_2SO_4}=0,2\left(mol\right);n_{K_2SO_4}=0,4\left(mol\right)\)
\(\rightarrow m_{Na_2SO_4}=0,2.142=28,4\left(g\right);m_{K_2SO_4}=0,4.174=69,6\left(g\right)\)
- Khối lượng dung dịch A: \(m_{ddA}=102+28,4+69,6=200g\)
- Nồng độ phần trăm các chất trong dung dịch A:
\(C\%_{Na_2SO_4}=\frac{28,4}{200}.100\%=14,2\%;\)\(C\%_{K_2SO_4}=\frac{69,6}{200}.100\%=34,8\%\)

\(PTHH:S+O_2\underrightarrow{t^o}SO_2\\ SO_2+\frac{1}{2}O_2\xrightarrow[V_2O_5]{t^o}SO_3\\ SO_3+H_2O\rightarrow H_2SO_4\)
\(m_{S\cdot trong\cdot FeS_2}=320.10^6.45\%=144.10^6\left(g\right)\)
\(n_S=\frac{144.10^6}{32}=45.10^5\left(mol\right)\)
Theo pt: \(n_S=n_{SO_2}=n_{SO_3}=n_{H_2SO_4}\)
\(\Rightarrow n_{H_2SO_4}=45.10^5\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=45.10^5.98=441.10^6\left(g\right)=441\left(ton\right)\)
\(H=\frac{441}{450}.100\%=98\left(\%\right)\)

Sơ đồ chuyển hóa được mô tả như sau: FeS2 (1) SO2 (2) SO3 (3) H2SO4
Các phương trình hóa học tương ứng:
Phản ứng (1): Nung quặng pirit sắt trong không khí để tạo ra lưu huỳnh đioxit (SO2) và sắt(III) oxit (Fe2O3).4FeS2+11O2t∘2Fe2O3+8SO2
Phản ứng (2): Oxi hóa SO2 bằng O2 (xúc tác V2O5, nhiệt độ) để tạo ra lưu huỳnh trioxit (SO3).2SO2+O2V2O5,t∘2SO3
Phản ứng (3): Hấp thụ SO3 bằng nước để tạo ra axit sunfuric (H2SO4).SO3+H2O→H2SO4
Khối lượng quặng pirit là 500 kg. Tỷ lệ FeS2 trong quặng là 90%. Khối lượng FeS2 tinh khiết là: mFeS2=500 kg×90%=450 kg
Phân tử khối của FeS2 là: MFeS2=56+2×32=120 g/mol
Đổi khối lượng FeS2 ra gam để tính số mol: mFeS2=450 kg=450000 g nFeS2=120450000=3750 mol
heo phương trình phản ứng (1): 4FeS2+11O2→2Fe2O3+8SO2 Từ 4 mol FeS2 tạo ra 8 mol SO2, suy ra tỉ lệ mol là nSO2=2×nFeS2. Số mol SO2 lý thuyết là: nSO2 (lyˊ thuyeˆˊt)=2×3750=7500 mol
Hiệu suất phản ứng (1) là H = 80%. Số mol SO2 thực tế thu được là: nSO2 (thực teˆˊ)=7500×80%=6000 mol
Theo phương trình phản ứng (2): 2SO2+O2→2SO3 Từ 2 mol SO2 tạo ra 2 mol SO3, suy ra tỉ lệ mol là nSO3=nSO2. Số mol SO3 lý thuyết là: nSO3 (lyˊ thuyeˆˊt)=6000 mol
Hiệu suất phản ứng (2) là H = 75%. Số mol SO3 thực tế thu được là: nSO3 (thực teˆˊ)=6000×75%=4500 mol
Theo phương trình phản ứng (3): SO3+H2O→H2SO4 Từ 1 mol SO3 tạo ra 1 mol H2SO4, suy ra tỉ lệ mol là nH2SO4=nSO3. Hiệu suất phản ứng (3) là H = 100%, do đó số mol H2SO4 thu được bằng số mol SO3 thực tế. nH2SO4=4500 mol
Phân tử khối của H2SO4 là: MH2SO4=2×1+32+4×16=98 g/mol
Khối lượng H2SO4 tinh khiết là: mH2SO4=nH2SO4×MH2SO4=4500×98=441000 g Đổi sang kg: mH2SO4=441 kg
Khối lượng dung dịch H2SO4 là: mdd=C%mH2SO4=18%441 kg=0,18441=2450 kg
Sử dụng công thức liên hệ giữa khối lượng riêng (D), khối lượng (m) và thể tích (V): V=Dm Với: m=2450 kg=2450000 g D=1,8 g/ml Vdd=1,8 g/ml2450000 g≈1361111,11 ml Đổi sang lít: Vdd=1361,11 lıˊt Đổi sang mét khối: Vdd=1,36 m3
Vậy, từ 500 kg quặng pirit sắt chứa 90% FeS2, có thể điều chế được khoảng 1361,11 lít dung dịch H2SO4 18% (có D = 1,8 g/ml).

a. PTHH: \(2SO_2+O_2\rightarrow^{t^o}_{V_2O_5}2SO_3\) (đoạn này Latex OLM đánh nhiều hơi rối nên không hiểu thì hỏi nhé)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(300ml=0,3l\)
\(\rightarrow n_{H_2SO_4}=1.0,3=0,3mol\)
Theo phương trình \(n_{O_2}=n_{SO_3}=n_{H_2SO_4}=0,3mol\)
\(\rightarrow m_{SO_2}=64.0,3=19,2g\)
b. PTHH: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
\(n_{Al_2O_3}=\frac{15,3}{102}=0,15mol\)
Xét tỉ lệ \(n_{Al_2O_3}>\frac{n_{H_2SO_4}}{3}\)
Vậy \(Al_2O_3\) dư
Theo phương trình \(n_{Al_2\left(SO_4\right)_3}=\frac{1}{3}n_{H_2SO_4}=0,1mol\)
\(\rightarrow C_{M_{Al_2\left(SO_4\right)_3}}=\frac{0,1}{0,3}=0,33M\)