Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Mình hệ thống lại tính chất hóa học của các loại oxit để bạn dễ học nhé 👇
1. Oxit axit (thường là oxit của phi kim hoặc kim loại có số oxi hoá cao, ví dụ: SO₂, CO₂, P₂O₅, N₂O₅, …)
- Tác dụng với nước → tạo dung dịch axit.
\(S O_{3} + H_{2} O \rightarrow H_{2} S O_{4}\) - Tác dụng với bazơ → tạo muối và nước.
\(C O_{2} + C a \left(\right. O H \left.\right)_{2} \rightarrow C a C O_{3} \downarrow + H_{2} O\)
2. Oxit bazơ (thường là oxit của kim loại, ví dụ: Na₂O, CaO, CuO, Fe₂O₃, …)
- Tác dụng với nước → tạo dung dịch bazơ (nếu oxit tan).
\(C a O + H_{2} O \rightarrow C a \left(\right. O H \left.\right)_{2}\) - Tác dụng với axit → tạo muối và nước.
\(C u O + 2 H C l \rightarrow C u C l_{2} + H_{2} O\)
3. Oxit lưỡng tính (ZnO, Al₂O₃, Cr₂O₃, …)
- Tác dụng với axit → tạo muối và nước.
\(Z n O + 2 H C l \rightarrow Z n C l_{2} + H_{2} O\) - Tác dụng với bazơ mạnh (khi nung nóng hoặc dung dịch kiềm đặc) → tạo muối và nước.
\(Z n O + 2 N a O H \rightarrow N a_{2} Z n O_{2} + H_{2} O\)
4. Oxit trung tính (CO, NO, N₂O, …)
- Không tác dụng với axit, bazơ, muối, cũng không tác dụng với nước.
✅ Tóm gọn:
- Oxit axit + bazơ → muối + nước.
- Oxit bazơ + axit → muối + nước.
- Oxit lưỡng tính + axit/bazơ → muối + nước.
- Oxit trung tính: hầu như không phản ứng.

- muối tác dụng với kim loại tạo ra muối mới và kim loại mới (với kim loại tham gia phản ứng mạnh hơn kim loại có trong muối)
- muối tác dụng với aicd tạo thành muối mới và acid mới (với sản phẩm là chất khí, chất kết tủa hoặc nước)
- muối tác dụng với base tạo thành muối mới và base mới (với sản phảm là chất khí, chất kết tủa hoặc nước)
- muối tác dụng với muối tạo thành 2 muối mới (với sản phẩm là chất khí, chất kết tủa hoặc nước)

oxide base: \(Na_2O\) (tác dụng với nước tạo base)
oxide acid: \(SO_3\) (tác dụng với nước tạo acid)
oxide lưỡng tính: \(Al_2O_3\) (tác dụng được với `H_2O`, acid, base)
oxide trung tính: \(N_2O\) (không có tính chất base, acid)
Oxit bazo: Na2O
Oxit Axit: SO3
Oxit lưỡng tính: Al2O3
Oxit trung tính: N2O

1. Định nghĩa về muối
Muối là hợp chất hóa học được tạo thành từ sự kết hợp giữa cation (ion mang điện dương) và anion (ion mang điện âm). Cation có thể là ion kim loại (như Na⁺, Ca²⁺) hoặc ion amoni (NH₄⁺), trong khi anion có thể là ion gốc axit (ví dụ: Cl⁻, SO₄²⁻, NO₃⁻).
- Muối được hình thành khi:
- Ion H⁺ của acid (ví dụ: HCl, H₂SO₄) được thay thế bằng một ion kim loại (ví dụ: Na⁺, Mg²⁺) hoặc ion amoni (NH₄⁺).
- Ví dụ: khi HCl phản ứng với NaOH, ta thu được NaCl (muối clorua natri) và nước.
2. Khả năng tan trong nước của muối
Muối có khả năng hòa tan trong nước khác nhau, phụ thuộc vào các yếu tố như:
- Loại muối: Một số muối tan tốt trong nước, một số muối chỉ tan ít hoặc không tan.
- Nhiệt độ nước: Một số muối có thể tan tốt hơn ở nhiệt độ cao hơn.
- Sự hiện diện của các ion khác trong dung dịch: Các ion có thể ảnh hưởng đến độ tan của muối, ví dụ trong dung dịch bão hòa.
Các nhóm muối có thể phân loại theo khả năng tan:
- Muối tan nhiều: Các muối này có thể hòa tan dễ dàng trong nước, ví dụ NaCl (muối ăn), KNO₃ (muối kali nitrat).
- Muối tan ít: Các muối này hòa tan một lượng nhỏ trong nước, ví dụ AgCl (muối bạc clorua), BaSO₄ (muối bari sulfat).
- Muối không tan: Một số muối gần như không tan trong nước, ví dụ PbSO₄ (muối chì(II) sulfat).
3. Tên muối (chứa cation kim loại)
Khi gọi tên các muối, ta dựa vào hai yếu tố chính: tên của cation (ion mang điện dương) và tên của anion (ion mang điện âm). Quy tắc đặt tên muối chứa cation kim loại được thực hiện như sau:
- Tên kim loại: Nếu kim loại có nhiều hóa trị (như Fe, Cu, Pb, Sn), ta phải chỉ rõ hóa trị của nó bằng cách ghi số hóa trị trong dấu ngoặc đơn sau tên kim loại. Nếu kim loại chỉ có một hóa trị (như Na, K, Ca), ta không cần chỉ hóa trị.
- Tên gốc axit: Đối với gốc axit, ta lấy tên gốc của axit, thay thế "-ic" bằng "-at" đối với axit có gốc axit "-ic" (ví dụ: H₂SO₄ → SO₄²⁻), và thay "-ous" bằng "-it" đối với axit có gốc "-ous" (ví dụ: H₂SO₃ → SO₃²⁻).
Ví dụ:
- FeCl₂: Tên là sắt(II) clorua. Kim loại sắt có hóa trị II, và anion là clorua (Cl⁻).
- FeCl₃: Tên là sắt(III) clorua. Kim loại sắt có hóa trị III, và anion là clorua.
- CuSO₄: Tên là đồng(II) sulfat. Kim loại đồng có hóa trị II, và anion là sulfat (SO₄²⁻).
- NaCl: Tên là natri clorua. Kim loại natri chỉ có hóa trị I, và anion là clorua.
Tóm tắt lại các điểm quan trọng:
- Muối là hợp chất tạo thành từ sự thay thế ion H⁺ của axit bởi ion kim loại hoặc ion amoni (NH₄⁺).
- Khả năng tan trong nước của muối có sự khác biệt rõ rệt, có muối tan tốt, muối tan ít và muối không tan.
- Cách gọi tên muối: Tên muối bao gồm tên cation (kèm hóa trị nếu cần) và tên gốc của axit.

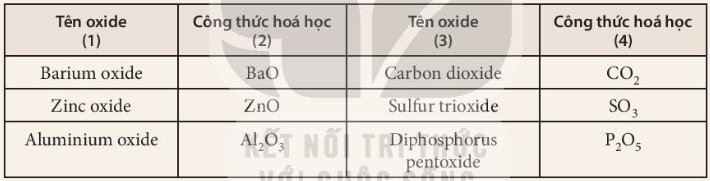
Nhận xét: Công thức phân tử của các oxide ở cột (2), (4) đều có chứa 2 nguyên tố, trong đó có 1 nguyên tố là oxygen (O).
1. Khái niệm oxide: Oxide là hợp chất của hai nguyên tố trong đó có một nguyên tố là oxygen.
2. Phân loại oxide:
- Dựa vào thành phần nguyên tố, oxide có thể phân thành hai loại: oxide kim loại và oxide phi kim.
- Dựa vào tính chất hoá học, oxide có thể phân thành 4 loại: oxide acid (SO2, CO2, SO3,...); oxide base (K2O, MgO, CaO); oxide lưỡng tính (Al2O3, ZnO,..) và oxide trung tính (CO, NO,...)

- Tính chất hoá học của oxide base:
+ Tác dụng với oxide acid: MgO + CO2 -> MgCO3
+ Tác dụng với dung dịch acid: MgO + 2HCl -> MgCl2 + H2O
+ Tác dụng với nước tạo dung dịch base: MgO là oxide base không tan nên không có phản ứng với nước.
- Tính chất hoá học của oxide acid:
+ Tác dụng với oxide base: SO2 + K2O -> K2SO3
+ Tác dụng với dung dịch base: SO2 + 2 KOH -> K2SO3 + H2O
+ Tác dụng với nước tạo dung dịch acid: \(SO_2+H_2O⇌H_2SO_3\)

Oxide acid: CO2 , SO2, SO3
Oxide bazo: CuO, Na2O,
Oxide lưỡng tính: Al2O3

Vôi sống (calcium oxide) phản ứng với một số chất có mặt trong không khí như sau:
Calcium oxide + Carbon dioxide ——> Calcium carbonate
Calcium oxide + Nước ——> Calcium hydroxide
Khi làm thí nghiệm, một học sinh quên đậy nắp lọ đựng vôi sống (thành phần chính là CaO), sau một thời gian thì khối lượng của lọ sẽ tăng lên.
\(CaO+CO_2\rightarrow CaCO_3\\ CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
Khi làm thí nghiệm, 1 HS quên đậy nắp lọ vôi sống sau một thời gian thì khối lượng của lọ tăng lên
1. Định nghĩa về Oxide:
\(X_{n} O_{m}\)
Trong đó \(X\) là nguyên tố, \(n\) và \(m\) là số nguyên dương chỉ số lượng nguyên tử của \(X\) và oxy trong phân tử oxide.
2. Phân loại Oxide theo thành phần nguyên tố:
a. Oxide kim loại (Oxide của kim loại):
b. Oxide phi kim (Oxide của phi kim):
3. Phân loại Oxide theo tính chất hóa học:
Dựa trên tính chất hóa học, oxide có thể được chia thành bốn loại chính: oxide acid, oxide base, oxide lưỡng tính, và oxide trung tính.
a. Oxide acid:
\(C O_{2} + H_{2} O \rightarrow H_{2} C O_{3}\)
\(S O_{2} + H_{2} O \rightarrow H_{2} S O_{3}\)
b. Oxide base:
\(N a_{2} O + H_{2} O \rightarrow 2 N a O H\)
\(C a O + H_{2} O \rightarrow C a \left(\right. O H \left.\right)_{2}\)
c. Oxide lưỡng tính:
\(A l_{2} O_{3} + 6 H C l \rightarrow 2 A l C l_{3} + 3 H_{2} O\)\(A l_{2} O_{3} + 2 N a O H + 3 H_{2} O \rightarrow 2 N a \left[\right. A l \left(\right. O H \left.\right)_{4} \left]\right.\)
d. Oxide trung tính:
Tóm tắt:
Tham khảo