Câu 4: Trộn 60 gam bột Fe với 30 gam bột lưu huỳnh rồi đun nóng (không có không khí) thu được chất rắn A. Hòa tan A bằng dung dịch axit HCl dư được dung dịch B và khí C. Đốt cháy C cần V lít O2 (đktc) (biết các phản ứng xảy ra hoàng toàn). V lít khí oxi là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
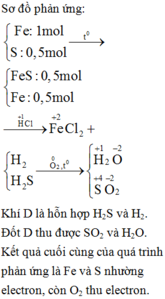
F e + S ⇒ M : F e , S , F e S → + H C l F e 2 + X : H 2 S , H 2 ; G : S → + O 2 H 2 O , S O 2
Có 3 chất thay đổi số oxi hóa là Fe, S và Oxi
Bảo toàn e: 4nO2 = 2nFe + 4nSO2 = 2. 0,1 + 4. 0,75= 0,5 mol
=> nO2 = 0,125 mol => V=2,8lít

Gọi x,y là số mol Fe phản ứng, Fe dư
Fe+S\(\rightarrow\)FeS
.x.....x.........x
FeS+2HCl−−−>FeCl2+H2S
.....x....................................x
Fe+2HCl−−−>FeCl2+H2
...y................................y
H2S+Pb(NO3)2−−−>PbS\(\downarrow\)+2HNO3
0,1..............................0,1........
Ta có: \(\dfrac{34x+2y}{x+y}\)=18
=> x=y=0,1
m\(_{Fe}\)bđ=m\(_{Fe}\) pứ + m\(_{Fe}\) dư =0,1.2.56=11,2(g)
m\(_S\)bđ=m\(_S\) pứ + m\(_S\) dư =0,1.32+0,8=4(g)


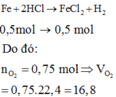
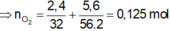
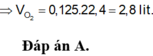
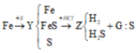

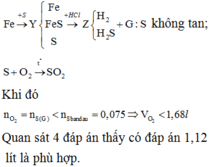
\(n_{Fe}=\dfrac{60}{56}=\dfrac{15}{14}\left(mol\right)\)
\(n_S=\dfrac{30}{32}=\dfrac{15}{16}\left(mol\right)\)
Bảo toàn e :
\(2n_{Fe}+4n_S=4n_{O_2}\)
\(\Rightarrow n_{O_2}=1.473\left(mol\right)\)
\(V=33\left(l\right)\)
Ta có: $n_{Fe}=\frac{60}{56}(mol);n_{S}=\frac{30}{32}$
Sau phản ứng Fe dư S hết
Bảo toàn e cho cả quá trình ta có: $n_{O_2}=1,47(mol)$
$\Rightarrow V_{O_2}=32,928(l)$