Hỗn hợp X gồm Mg và Fe3O4 (trong đó Mg chiem 9.375% khoi luong X). Cho một lượng X tan hết vào dung dịch gồm H2SO4 2M và KNO3 1M, thu được dung dịch Y chỉ chứa 17,87 gam muối trung hòa và 224 ml NO (đktc, sản phẩm khử duy nhất). Cho Y tác dụng với dung dịch Ba(OH)2 dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 30,88. B. 30,37. C. 15,63. D. 17,77.









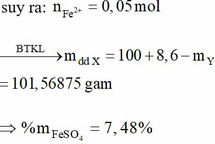
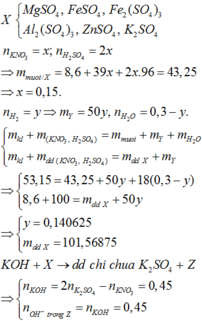
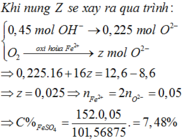


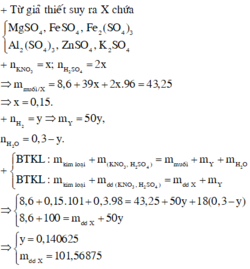

Theo gt ta có: \(n_{Mg}=n_{Fe_3O_4}=\dfrac{m}{256}\left(mol\text{ }\right)\)
$\Rightarrow m_{KL}=0,75m(g)$
Phương trình khối lượng muối ta có: $0,75m+231x+62x-62.0,01=17,87$
Bảo toàn khối lượng ta có: $m+297x=0,3+17,87+18.2x$
Giải hệ phương trình ta được $m=5,12$
Bảo toàn điện tích ta có $n_{OH^-}=0,19(mol)$
$\Rightarrow m_{kettua}=30,37(g)$