vẽ sơ đồ mô tả sự hình thành liên kết ion trong phân tử NaCL(muối ăn),magnesium oxide (MgO);liên kết cộng hóa trị trong phân tử nước (H2O),carbon đioxide(CO2).
giúp mình với :(
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

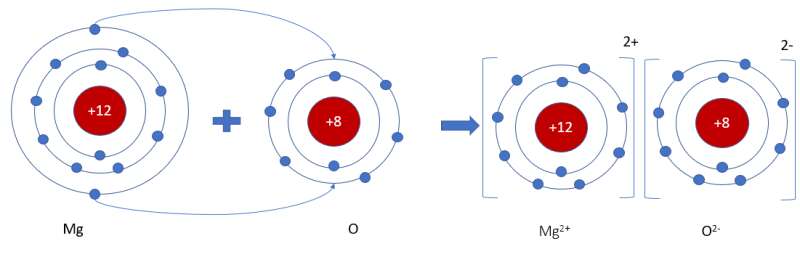
Khi hình thành phân tử `MgO,` các nguyên tử đã có sự nhường nhận `e` như sau:
`-` Nguyên tử `Mg` nhường `2e` ở lớp ngoài cùng cho nguyên tử `O` để tạo thành ion dương \(Mg^{2+}\) có vỏ bền vững giống khí hiếm `Ne`.
`-` Nguyên tử `O` nhận `2e` vào lớp ngoài cùng từ nguyên tử `Mg` để tạo thành ion âm \(O^{2-}\) có vỏ bền vừng giống khí hiếm `Ne`.
Hai ion trái dấu hút nhau, hình thành nên liên kết ion trong phân tử `MgO`.

tham khảo
- Nguyên tử Mg (có số hiệu nguyên tử = 12) nhường 2 electron cho O, tạo thành ion Mg2+
- Nguyên tử O (có số hiệu nguyên tử = 8) nhận 2 electron từ Mg, tạo thành ion O2-
=> Ion dương Mg2+ và ion âm O2- mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion
- Sơ đồ mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide:

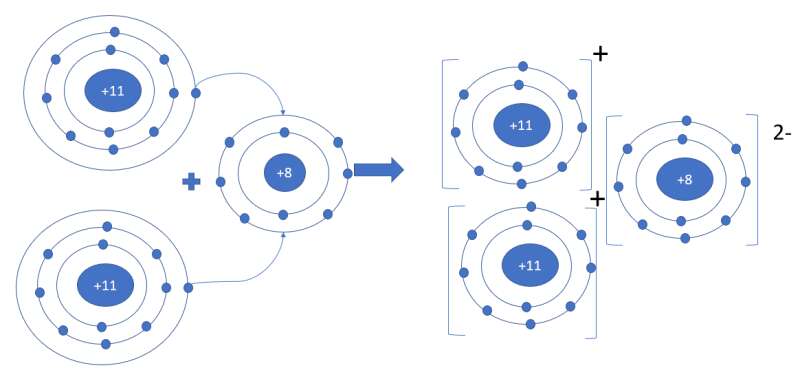
- Sodium oxide gồm 2 nguyên tố: Na (kim loại) và O (phi kim)
=> Liên kết ion
- Nguyên tử Na (số hiệu nguyên tử = 11) nhường 1 electron => Ion Na+
- Nguyên tử O (số hiệu nguyên tử = 8) nhận 2 electron => Ion O2-

Nguyên tử `Cl` dùng chung `1` cặp electron với nguyên tử `H`
`->` Trong phân tử muối `HCl,` nguyên tử nguyên tố `Cl` sẽ có hóa trị là `I`.
Khi hình thành phân tử M g O , MgO, các nguyên tử đã có sự nhường nhận e e như sau: − − Nguyên tử M g Mg nhường 2 e 2e ở lớp ngoài cùng cho nguyên tử O O để tạo thành ion dương M g 2 + Mg 2+ có vỏ bền vững giống khí hiếm N e Ne. − − Nguyên tử O O nhận 2 e 2e vào lớp ngoài cùng từ nguyên tử M g Mg để tạo thành ion âm O 2 − O 2− có vỏ bền vừng giống khí hiếm N e Ne. Hai ion trái dấu hút nhau, hình thành nên liên kết ion trong phân tử M g O MgO.
để nhờ nha