1 bình kín dung tích 5,6 lít chứa đầy không khí (đktc). Cho vào bình 10 gam P và đốt. hỏi P có cháy hết không?.Biết oxi chiếm 20% thể tích không khí
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_P=\dfrac{m}{M}=0,2\left(mol\right)\)
- Ta có : \(V_{O_2}=\dfrac{V_{kk}}{5}=4,48\left(l\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=0,2\left(mol\right)\)
\(4P+5O_2\rightarrow2P_2O_5\)
- Theo phương pháp đường chéo ta có :
=> Sau phản ứng O2 phản ứng hết, P còn dư ( dư 0,04 mol )
Vậy sau phản ứng photpho không cháy hết .
b, - Chất được tạo thành là P2O5 .
Theo PTHH : \(n_{P2O5}=\dfrac{n_P}{2}=\dfrac{0,16}{2}=0,08\left(mol\right)\)
\(\Rightarrow m_{P2O5}=n.M=11,36\left(g\right)\)

\(n_P=\dfrac{5}{31}=0,16mol\)
\(V_{O_2}=\dfrac{V_{kk}}{5}=\dfrac{2,8}{5}=0,56l\)
\(n_{O_2}=\dfrac{0,56}{22,4}=0,025mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
\(\dfrac{0,16}{4}\)< \(\dfrac{0,25}{5}\) ( mol )
0,16 0,08 ( mol )
\(m_{P_2O_5}=0,08.142=11,36g\)

\(a) n_P = \dfrac{18,6}{31} = 0,6(mol)\\ n_{O_2} = \dfrac{20,16}{22,4} = 0,9(mol)\\ 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\\ \dfrac{n_P}{4} = 0,15 < \dfrac{n_{O_2}}{5} = 0,18 \to O_2\ dư\\ n_{O_2\ pư} = \dfrac{5}{4}n_P = 0,75(mol)\\ \Rightarrow m_{O_2\ dư} = (0,9-0,75).32 = 4,8(gam)\\ b) n_{Fe} = \dfrac{56}{56} = 1(mol)\)
\(3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\\ \dfrac{n_{Fe}}{3} = \dfrac{1}{3}<\dfrac{n_{O_2}}{2} = 0,45\to Fe\ cháy\ hết.\\ c)\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,9.2 = 1,8(mol)\\ \Rightarrow m_{KMnO_4} = 1,8.158 =284,4(gam)\)

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\) - pư hóa hợp
b, \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(V_{O_2}=36,96.20\%=7,392\left(l\right)\Rightarrow n_{O_2}=\dfrac{7,392}{22,4}=0,33\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,4}{1}>\dfrac{0,33}{5}\), ta được P dư.
Theo PT: \(n_{P\left(pư\right)}=\dfrac{4}{5}n_{O_2}=0,264\left(mol\right)\Rightarrow n_{P\left(dư\right)}=0,4-0,264=0,136\left(mol\right)\)
\(\Rightarrow m_{P\left(dư\right)}=0,136.31=4,216\left(g\right)\)
c, \(n_{P_2O_5}=\dfrac{2}{5}n_{O_2}=0,132\left(mol\right)\Rightarrow m_{P_2O_5}=0,132.142=18,744\left(g\right)\)

a, \(n_{C_2H_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PT: \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
Theo PT: \(n_{CaCO_3}=n_{CO_2}=2n_{C_2H_4}=0,1\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=0,1.100=10\left(g\right)\)
b, Theo PT: \(n_{O_2}=3n_{C_2H_4}=0,15\left(mol\right)\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
\(\Rightarrow V_{kk}=\dfrac{V_{O_2}}{20\%}=16,8\left(l\right)\)

\(n_{C_2H_4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PT: \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Theo PT: \(n_{O_2}=3n_{C_2H_4}=0,75\left(mol\right)\Rightarrow V_{O_2}=0,75.22,4=16,8\left(l\right)\)
\(\Rightarrow V_{kk}=\dfrac{V_{O_2}}{20\%}=84\left(l\right)\)

Bạn tham khảo tại đây nhé
https://sites.google.com/site/hoahocquan10/bai-tap/bai-tap-hoa-8/hoa-8-chuong-iv

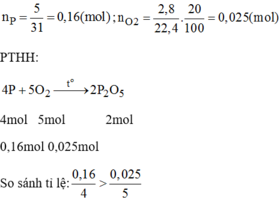
Vậy P dư nen tính bài toán theo n O 2
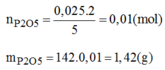
Khối lượng P 2 O 5 thực tế thu được: 1,42.80% = 1,136(g)
P sẽ không cháy hết
$\rm n_{kk}=\dfrac{5,6}{22,4}=0,25(mol)$
$\to$ $\rm n_{O_2}=20\%.0,25=0,05(mol)$
$\rm n_P=\dfrac{10}{31}=0,3225(mol)$
Phương trình hóa học
$\rm 4P+5O_2 \xrightarrow{to} 2P_2O_5$
Tỉ lệ $\rm \dfrac{0,3225}{4}>\dfrac{0,05}{5}$ `->` $\rm P$ không cháy hết