tính khối lượng H2SO4 có trong 100ml dung dịch H2SO4 1M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(m_{NaOH}=0,2.40=8\left(g\right)\)
b, \(n_{H_2SO_4}=2.0,1=0,2\left(mol\right)\)
\(c,C\%=\dfrac{6}{200}.100\%=3\%\)
\(m_{NaCl}=\dfrac{200.8}{100}=16\left(g\right)\)

\(n_{NaOH}=\dfrac{12}{40}=0.3\left(mol\right)\)
\(n_{H_2SO_4}=0.1\cdot1=0.1\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(0.2..............0.1................0.1\)
\(m_A=m_{Na_2SO_4}+m_{NaOH\left(dư\right)}=0.1\cdot142+\left(0.3-0.2\right)\cdot40=18.2\left(g\right)\)

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\n_{H_2SO_4}=0,1\cdot0,5=0,05\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{2}>\dfrac{0,05}{3}\) \(\Rightarrow\) Al còn dư, H2SO4 phản ứng hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,05mol\\n_{Al\left(dư\right)}=\dfrac{1}{6}\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{60}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{H_2}=0,05\cdot2=0,1\left(g\right)\\m_{Al\left(dư\right)}=\dfrac{1}{6}\cdot27=4,5\left(g\right)\\m_{Al_2\left(SO_4\right)_3}=\dfrac{1}{60}\cdot342=5,7\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{ddH_2SO_4}=100\cdot1,05=105\left(g\right)\)
\(\Rightarrow m_{dd}=m_{ddH_2SO_4}+m_{Al}-m_{Al\left(dư\right)}-m_{H_2}=105,8\left(g\right)\)
\(\Rightarrow C\%_{Al_2\left(SO_4\right)_3}=\dfrac{5,7}{105,8}\cdot100\%\approx5,39\%\)

$n_{Ba^{2+}} = 0,1.0,5 = 0,05 < n_{SO_4^{2-}} = 0,1$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,05(mol)$
$m_{BaSO_4} = 0,05.233 = 11,65(gam)$
$n_{OH^-} = 0,1.0,5.2 + 0,1.0,5 = 0,15(mol)$
$n_{H^+} = 0,1.2 = 0,2(mol)$
$H^+ + OH^- \to H_2O$
$n_{H^+\ dư} = 0,2 - 0,15 = 0,05(mol)$
$V_{dd} = 0,1 + 0,1 + 0,1 = 0,3(lít)$
$[H^+] = \dfrac{0,05}{0,3} = \dfrac{1}{6}M$
$pH = -log( \dfrac{1}{6} ) = 0,778$
\(n_{Ba^{2+}}=0.1\cdot0.5=0.05\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.5\cdot2+0.1\cdot0.5=0.15\left(mol\right)\)
\(n_{H^+}=2\cdot0.1\cdot1=0.2\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.05.........0.05.............0.05\)
\(SO_4^{2-}dư\)
\(m_{\downarrow}=0.05\cdot233=11.65\left(g\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.15.......0.15\)
\(n_{H^+\left(dư\right)}=0.2-0.15=0.05\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.05}{0.1+0.1+0.1}=\dfrac{1}{6}\)
\(pH=-log\left(\dfrac{1}{6}\right)=0.77\)

nH2SO4=0,1(mol)
a) PTHH: 2 NaOH + H2SO4 -> Na2SO4 + 2 H2O
b) 0,2___________0,1________0,1(mol)
mNaOH=0,2.40=8(g)
=>mddNaOH=(8.100)/25= 32(g)
c) mNa2SO4=0,1.142=14,2(g)
d) PTHH: 2 KOH + H2SO4 -> K2SO4 +2 H2O
nKOH=0,2(mol) => mKOH=0,2.56=11,2(g)
=> mddKOH=(11,2.100)/8=140(g)
=> VddKOH= 140/1,085=129,03(ml)
Chúc em học tốt!

Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên: 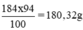
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất: 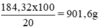
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%: 901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.

Ta có:
n H 2 SO 4 = 0 , 2 x 2 , 5 + 0 , 1 x 1 = 0 , 6 ( mol )
→ C M sau khi trộn = 0,6/0,3 = 2M.

\(n_{KOH}=0.1\cdot1=0.1\left(mol\right)\)
\(n_{HCl}=0.1\cdot0.5=0.05\left(mol\right)\)
\(KOH+HCl\rightarrow KCl+H_2O\)
\(0.05.......0.05.......0.05\)
Dung dịch D : 0.05 (mol) KOH , 0.05 (mol) KCl
\(\left[K^+\right]=\dfrac{0.05+0.05}{0.1+0.1}=0.5\left(M\right)\)
\(\left[Cl^-\right]=\dfrac{0.05}{0.2}=0.25\left(M\right)\)
\(\left[OH^-\right]=\dfrac{0.05}{0.2}=0.25\left(M\right)\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
\(0.05.........0.025\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.025}{1}=0.025\left(l\right)\)

2)
Zn+ H2SO4 ---> ZnSO4+ H2↑
0.1 0.1
nH2= \(\dfrac{2,24}{22,4}\)0.1 mol
mZn= 0.1x65=6.5 g
mCu=10.5-6,5=4 g
%mZn=\(\dfrac{6,5}{10,5}\).100%=61.9%
%mCu=\(\dfrac{4}{10,5}\)x100%=38.1%
Ta có: nH2SO4 = 0,1.1 = 0,1 (mol)
⇒ mH2SO4 = 0,1.98 = 9,8 (g)