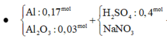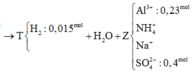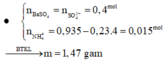Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo gt ta có: $n_{Al}=0,17(mol);n_{Al_2O_3}=0,03(mol);n_{BaSO_4}=n_{SO_4^{2-}}=0,4(mol)$
Bảo toàn điện tích cho dung dịch cuối ta có:
$n_{Na^+/Z}=0,095(mol)$
Phản ứng với NaOH ta thu được $n_{NH_3}=n_{NH_4^+}=0,015(mol)$
Bảo toàn H ta có: $n_{H_2O}=0,355(mol)$
Bảo toàn khối lượng ta có: $m_{khí}=1,47(g)$

Theo gt ta có: $n_{Al}=0,17(mol);n_{Al_2O_3}=0,03(mol);n_{BaSO_4}=n_{SO_4^{2-}}=0,4(mol)$
Bảo toàn điện tích cho dung dịch cuối ta có:
$n_{Na^+/Z}=0,095(mol)$
Phản ứng với NaOH ta thu được $n_{NH_3}=n_{NH_4^+}=0,015(mol)$
Bảo toàn H ta có: $n_{H_2O}=0,355(mol)$
Bảo toàn khối lượng ta có: $m_{khi}=1,47(g)$

Đáp án D.
![]()
![]()
- Khi cho dung dịch Z tác dụng với BaCl2 dư thì : ![]()
- Xét quá trình hỗn hợp X tác dụng với dung dịch Y ta có :
![]()
![]()
![]()
- Khi dung dịch Z tác dụng với 0,935 mol NaOH thì: ![]()
![]()
![]()
![]()
![]()
![]()

Chọn đáp án D
7,65 gam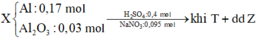
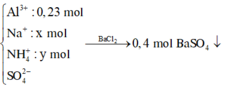
Do khí T chỉ chứa H2 → NO3- phản ứng hết → muối Z là muối SO42-.
Khi cho Z phản ứng với NaOH tạo dung dịch chứa Na2SO4 : 0,4 mol và NaAlO2: 0,23 mol
Bảo toàn nguyên tố Na → x + 0,935 = 0,4.2 + 0,23 → x = 0,095 mol
Bảo toàn điện tích trong Z → y = 0,4.2 - 0,23.3 - 0,095 = 0,015 mol
Bảo toàn nguyên tố H → nH2O =( 0,4.2 - 4. 0,015- 2. 0,015 ) : 2= 0,355 mol
Bảo toàn khối lượng :
mkhí = 7,65 + 0,095. 85 + 0,4. 98 - 0,23. 27 - 0,015. 18 - 0,4. 96 - 0,095. 23 - 0,355. 18 = 1,47 gam. Đáp án D.