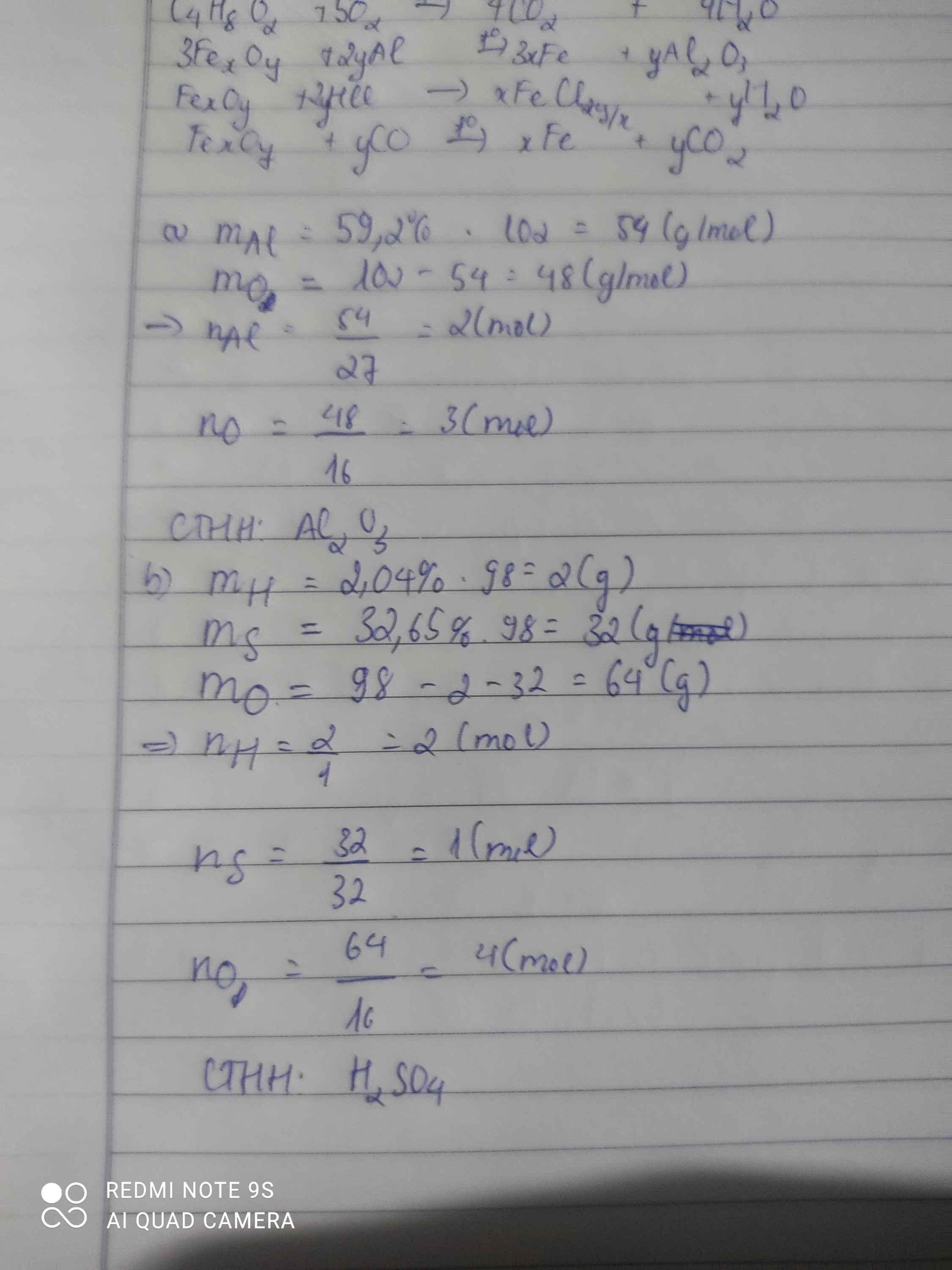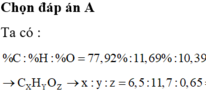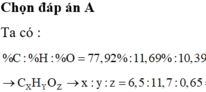Một chất có ứng dụng rộng rãi ở các vùng quê,có thành phần % về khối lượng các nguyên tố K,Al,S lần lượt là 8,228 % , 5,696 % , 13,502 % còn lại là oxi và hiđro.Xác định công thức của chất đó.Biết trong chất đó S có số oxi hóa cao nhất Chỉ mình cách bấm phần tỉ lệ với mình không biết bấm Giải chỉ tiết nha đừng sao chép mạng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 2:
\(Đặt.CTTQ.của.A:H_xS_yO_z\left(x,y,z:nguyên,dương\right)\\ Ta.có:\left\{{}\begin{matrix}x=\dfrac{98.2,04\%}{1}=2\\y=\dfrac{98.32,65\%}{32}=1\\z=\dfrac{98.\left(100\%-2,04\%-32,65\%\right)}{16}=4\end{matrix}\right.\\ \Rightarrow x=2;y=1;z=4\\ \Rightarrow CTHH:H_2SO_4\)
Bài 1: Sửa đề 59,2% Al thành 52,9% Al
\(Đặt.CTTQ:Al_xO_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{52,9\%.102}{27}\approx2\\ \Rightarrow y\approx\dfrac{\left(100\%-52,9\%\right).102}{16}\approx3\\ \Rightarrow CTHH:Al_2O_3\)

Gọi công thức chung là FexSyOz
%O2=48%
x:y:z=\(\dfrac{28}{56}:\dfrac{24}{32}:\dfrac{48}{16}=0,5:0,75:3=2:3:12\)
=> CTHH Fe2(SO4)3
tên: Sắt (III)sunfat

Trong 1 mol hợp chất:
$n_H=\dfrac{98.2,04\%}{1}\approx 2(mol)$
$n_S=\dfrac{98.32,65\%}{32}\approx 1(mol)$
$n_O=\dfrac{98-2-32}{16}=4(mol)$
$\to CTHH:H_2SO_4$