xác định vị trí và nêu tính chất cơ bản của nguyên tố A trong bảng tuần hoàn.Biết hạt nhân nguyên tử có nguyên tố A có 24 hạt,trong đó hạt không mang điện là 12
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Số hạt mang điện là:(40 + 12): 2 = 26 hạt
Số hạt không mang điện là: 40 - 26 = 14 hạt
Nguyên tố x là Fe(sắt) vì trong bảng tuần hoàn hoá học điện tích hạt nhân của Fe = 26.

Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố A là 58 : p + e + n = 58 hay 2p + n = 58 (do p = e) (1)
Số hạt p ít hơn số hạt n là 1 hạt : n - p =1 (2)
Giải (1), (2) ta có p = e = 19, n = 20
Vậy số hiệu nguyên tử (z) = 19
Số khối (A) = p + n = 19 + 20 = 39
Kí hiệu nguyên tử:

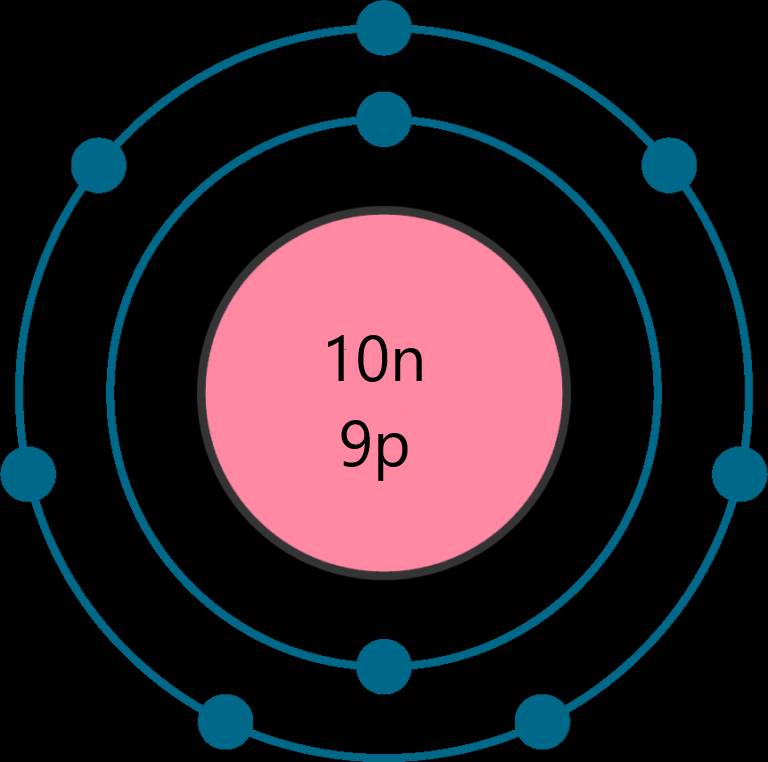
Tổng số các loại hạt là 28, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 8
⇒ Số neutron là 10 hạt
Số proton là 9 hạt
Số electron là 9 hạt
⇒ Nguyên tố Fluorine - ô số 9, chu kì 2, nhóm VIIA trong bảng tuần hoàn

a)
Ta có:
$2p + n = 46$ và $2p = 1,88n$
Suy ra p = 15 ; n = 16
Vậy X có 15 hạt proton, 15 hạt electron, 16 hạt notron
b)
Vị trí : Ô 15, nhóm VA, chu kì 3
c)
Khi X nhận thêm 3 electron thì tạo ra ion $P^{3-}$

anh làm chi tiết câu 2 thôi nhé, tại vì dài quá
2.
Ta có: \(\left\{{}\begin{matrix}p+e+n=92\\p=e\\p+e-n=24\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2n=68\\p=e\\p+e+n=92\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}n=34\\p=e=z=29\end{matrix}\right.\)
\(\Rightarrow A=z+n=29+34=63\left(u\right)\)
\(KHNT:^{63}_{29}Cu\)
3.
Ta có: \(\left\{{}\begin{matrix}p+e+n=155\\p=e\\p+e-n=33\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=z=47\\n=61\end{matrix}\right.\)
\(\Rightarrow A=z+n=47+61=108\left(u\right)\)
\(KHNT:^{108}_{47}Ag\)
4.
Ta có: \(\left\{{}\begin{matrix}p+e+n=58\\p=e\\p+e-n=18\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=z=19\\n=20\end{matrix}\right.\)
\(\Rightarrow A=z+n=19+20=39\left(u\right)\)
\(KHNT:^{39}_{19}K\)
5.
Ta có: \(\left\{{}\begin{matrix}p+e+n=115\\p=e\\p+e-n=25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=z=35\\n=45\end{matrix}\right.\)
\(\Rightarrow A=z+n=35+45=80\left(u\right)\)
\(KHNT:^{80}_{35}Br\)
6.
Ta có: \(\left\{{}\begin{matrix}p+e+n=40\\p=e\\p+e-n=12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=z=13\\n=14\end{matrix}\right.\)
\(\Rightarrow A=z+n=13+14=27\left(u\right)\)
\(KHNT:^{27}_{13}Al\)
7.
Ta có: \(\left\{{}\begin{matrix}p+e+n=82\\p=e\\p+e-n=22\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=z=26\\n=30\end{matrix}\right.\)
\(\Rightarrow A=z+n=26+30=56\left(u\right)\)
\(KHNT:^{56}_{26}Fe\)
8.
Ta có: \(\left\{{}\begin{matrix}p+e+n=40\\p=e\\n-p=1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=z=13\\n=14\end{matrix}\right.\)
\(\Rightarrow A=z+n=13+14=27\left(u\right)\)
\(KHNT:^{27}_{13}Al\)
9.
Ta có: \(\left\{{}\begin{matrix}p+e+n=108\\p=e\\n-p=9\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=z=33\\n=42\end{matrix}\right.\)
\(\Rightarrow A=z+n=33+42=75\left(u\right)\)
\(KHNT:^{75}_{33}As\)
10.
Ta có: \(\left\{{}\begin{matrix}p+e+n=34\\p=e\\n-e=1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=z=11\\n=12\end{matrix}\right.\)
\(\Rightarrow A=z+n=11+12=23\left(u\right)\)
\(KHNT:^{23}_{11}Na\)


Hạt nhân nguyên tử của nguyên tố A có 24 hạt:
\(2P+N=24\)
Số hạt không mang điện là 12:
\(N=12\)
=> \(2P+12=24\Rightarrow P=\dfrac{24-12}{2}=6\)
=> A là nguyên tố Cacbon.
Cấu hình e: \(1s^22s^22p^2\)
Vị trí: ô số 6 trong bảng tuần hoàn, chu kì 2, nhóm IVA
Tính chất cơ bản của A: tính phi kim xu hướng nhận e, không màu, không mùi, khả năng dẫn điện và nhiệt kém.