Cho dung dịch Ba(OH )2 tác dụng với 100 ml dung dịch HCl 2M ( D = 1,92 g / ml ) tính C% BaCl2 sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


100ml = 0,1l
Số mol của HCL là :
\(C_M=\dfrac{n}{V}=>n=C_M.V=2.0,1=0,2\left(mol\right)\)
Phương trình phản ứng là :
\(2HCL+Ba\left(OH\right)_2->BaCl_2+2H_2O\)
Số mol của \(Ba\left(OH\right)_2\) là :
\(n_{Ba\left(OH\right)_2}=\dfrac{1}{2}n_{HCL}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
\(n_{BaCl_2}=\dfrac{1}{2}n_{HCL}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
a) Thể tích dung dịch \(Ba\left(OH\right)_2\) là :
\(C_M=\dfrac{n}{V}=>V=\dfrac{n}{C_M}=\dfrac{0,1}{0,2}=0,5\left(l\right)\)
b) Thể tích của \(BaCl_2\) (đktc) là :
\(V_{BaCl_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
Nồng động dung dịch của \(BaCl_2\) là :
\(C_M=\dfrac{n}{V}=\dfrac{0,1}{2,24}=0,446M\)

\(n_{H_2SO_4}=0.1\cdot2=0.2\left(mol\right)\)
\(m_{dd_{H_2SO_4}}=100\cdot1.2=120\left(g\right)\)
\(n_{BaCl_2}=0.1\cdot1=0.1\left(mol\right)\)
\(m_{dd_{BaCl_2}}=100\cdot1.32=132\left(g\right)\)
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
\(0.1................0.1.........0.1...............0.2\)
\(\Rightarrow H_2SO_4dư\)
\(m_{BaSO_4}=0.1\cdot233=23.3\left(g\right)\)
\(V_{dd}=0.1+0.1=0.2\left(l\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.2-0.1}{0.2}=0.5\left(M\right)\)
\(C_{M_{HCl}}=\dfrac{0.2}{0.2}=1\left(M\right)\)
\(m_{\text{dung dịch sau phản ứng}}=120+132-23.3=228.7\left(g\right)\)
\(C\%_{H_2SO_4\left(dư\right)}=\dfrac{0.1\cdot98}{228.7}\cdot100\%=4.28\%\)
\(C\%_{HCl}=\dfrac{0.2\cdot36.5}{228.7}\cdot100\%=3.2\%\)

a, \(2HCl+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\)
b, \(n_{HCl}=0,06.0,1=0,006\left(mol\right)\)
Theo PT: \(n_{Ba\left(OH\right)_2}=\dfrac{1}{2}n_{HCl}=0,003\left(mol\right)\)
\(\Rightarrow V_{Ba\left(OH\right)_2}=\dfrac{0,003}{0,2}=0,015\left(l\right)=15\left(ml\right)\)
c, \(n_{BaCl_2}=\dfrac{1}{2}n_{Ba\left(OH\right)_2}=0,003\left(mol\right)\Rightarrow C_{M_{BaCl_2}}=\dfrac{0,003}{0,06+0,015}=0,04\left(M\right)\)

100ml = 0,1l
Số mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=2.0,1=0,2\left(mol\right)\)
100ml = 0,1l
Số mol của dung dịch bari nitrat
CMBa(NO3)2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,1=0,1\left(mol\right)\)
Pt : H2SO4 + Ba(NO3)2 → 2HNO3 + BaSO4\(|\)
1 1 2 1
0,2 0,1 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\)
⇒ H2SO4 dư , Ba(NO3)2 phản ứng hết
⇒ Tính toán dựa vào số mol của Ba(NO3)2
Số mol của axit nitric
nHNO3 = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Số mol dư của dung dịch axit sunfuric
ndư = nban đầu - nmol
= 0,2 - (0,1. 1)
= 0,1 (mol)
Thể tích của dung dịch sau phản ứng
Vdung dịch sau phản ứng = 0,1 + 0,1
= 0,2 (l)
Nồng độ mol của axit nitric
CMHNO3 = \(\dfrac{n}{V}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Nồng độ mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
⇒ Chọn câu : D
Chúc bạn học tốt

Chọn đáp án C
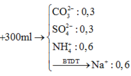
Xét trong 100 ml dung dịch X: 2H⁺ + CO32– → CO2 + H2O ⇒ nCO32– = nkhí = 0,1 mol.
Ba2+ + CO32– → BaCO3 || Ba2+ + SO42– → BaSO4 ⇒ nSO42– = (43 - 0,1 × 197) ÷ 233 = 0,1 mol.
NH4+ + OH– → NH3 + H2O ⇒ nNH4+ = nNH3 = 0,4 ÷ 2 = 0,2 mol.Bảo toàn điện tích: nNa+ = 0,2 mol.
⇒ mmuối trong 300ml X = 3 × (0,2 × 23 + 0,2 × 18 + 0,1 × 60 + 0,1 × 96) = 71,4(g) ⇒ chọn C.

\(n_{HCl}=Cm.V=1.0,1=1mol\)
\(n_{H_2SO_4}=Cm.V=0,5.0,1=0,05mol\)
Thể thích của dd D là 200ml = 0,2l
\([H^+]=\frac{n_{HCl}+2.n_{H_2SO_4}}{V}=\frac{0,1+0,1}{0,2}=1M\)
\([Cl^-]=\frac{n_{HCl}}{V}=\frac{0,1}{0,2}=0,5M\)
\([SO_4^{2-}]=\frac{n_{H_2SO_4}}{V}=\frac{0,05}{0,2}=0,25M\)
Khi cho dd D vào \(Ba\left(OH\right)_2\) chỉ có \(H_2SO_4\) tác dụng, tạo kết tủa
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
\(0,05....\rightarrow0,05mol\)
\(\rightarrow m_{BaSO_4}=n.M=0,05.233=11,65g\)

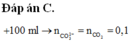
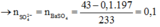
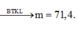
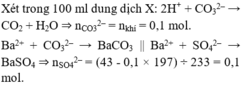
có mddBa(OH)2 không bn
ko đâu bn