Nung hỗn hợp gồm a gam bột sắt và b gam bột s trong điều kiện không có không khí thu được chất rắn A. Cho A tác dụng với axit H2SO4 loãng (dư) thu được khí B có tỷ khối so với H2 bằng 10,6; dung dịch C và còn lại 1,6 gan chất rắn không tan. Sục toàn bộ khí B vào dung dịch Pb(NO3)2 dư thu được 43,02 gam kết tủa. Viết phương trình phản ứng xảy ra và tính các giá trị a, b
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
\(n_{Fe} = \dfrac{5,6}{56} = 0,1(mol)\\ n_S = \dfrac{2,4}{32} = 0,075(mol)\)
Fe + S \(\xrightarrow{t^o}\) FeS
0,075.......0,075,,,,,,0,075...................(mol)
nFe dư = 0,1 - 0,075 = 0,025(mol)
Fe + 2HCl → FeCl2 + H2
0,025.....0,05..........................0,025............(mol)
FeS + 2HCl → FeCl2 + H2S
0,075.........0,15...........................0,075.............(mol)
\(\Rightarrow V_{dd\ HCl} = \dfrac{0,05+0,15}{1} = 0,2(lít)\)
b) VB = (0,025 + 0,075).22,4 = 2,24(lít)

Gọi x,y là số mol Fe phản ứng, Fe dư
Fe+S\(\rightarrow\)FeS
.x.....x.........x
FeS+2HCl−−−>FeCl2+H2S
.....x....................................x
Fe+2HCl−−−>FeCl2+H2
...y................................y
H2S+Pb(NO3)2−−−>PbS\(\downarrow\)+2HNO3
0,1..............................0,1........
Ta có: \(\dfrac{34x+2y}{x+y}\)=18
=> x=y=0,1
m\(_{Fe}\)bđ=m\(_{Fe}\) pứ + m\(_{Fe}\) dư =0,1.2.56=11,2(g)
m\(_S\)bđ=m\(_S\) pứ + m\(_S\) dư =0,1.32+0,8=4(g)

ĐÁP ÁN A
Hỗn hợp khí gồm H2 và H2S với số mol lần lượt là x và y
Chất rắn là S
=> x + y = 0,2 mol và 2x + 34y = 3,6g
=> x = y = 0,1 mol
Fe + S -> FeS
Bảo toàn e : nFe bđ = nFe dư + nFeS = 0,2 mol
=> nS (bđ) = 0,3 mol
=> nS dư = 0,3 – 0,1 = 0,2 mol
=> m = 6,4g


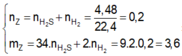
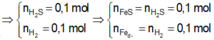
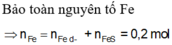
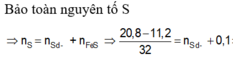
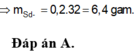
PT: \(Fe+S\underrightarrow{t^o}FeS\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(FeS+H_2SO_4\rightarrow FeSO_4+H_2S\)
\(H_2S+Pb\left(NO_3\right)_2\rightarrow2HNO_3+PbS\)
Ta có: mS (chưa pư) = 1,6 (g)
Theo PT: \(n_{S\left(pư\right)}=n_{FeS}=n_{H_2S}=n_{PbS}=\dfrac{43,02}{239}=0,18\left(mol\right)\)
⇒ ΣmS = 1,6 + 0,18.32 = 7,36 (g) = b
Ta có: dB/H2 = 10,6
\(\Rightarrow\dfrac{2n_{H_2}+34n_{H_2S}}{n_{H_2}+n_{H_2S}}=10,6.2\Rightarrow\dfrac{2n_{H_2}+34.0,18}{n_{H_2}+0,18}=10,6.2\)
\(\Rightarrow n_{H_2}=0,12\left(mol\right)\)
Theo PT: nFe (chưa pư) = nH2 = 0,12 (mol)
nFe (pư) = nFeS = 0,18 (mol)
⇒ mFe = (0,12 + 0,18).56 = 16,8 (g) = a
gam*