Cho biết phản ứng sau có ${\Delta _t},H_{298}^o$ > 0 và diễn ra ở ngay nhiệt độ phòng.
2NH4NO3(s) + Ba(OH)2.8H2O(s) → 2NH3(aq) + Ba(NO3)2(aq) + 10H2O(l)
Khi trộn đều một lượng ammonium nitrate (NH4NO3) rắn với một lượng barium hydroxide ngậm nước (Ba(OH)2.8H2O) ở nhiệt độ phòng thì nhiệt độ của hỗn hợp sẽ tăng hay giảm? Giải thích.

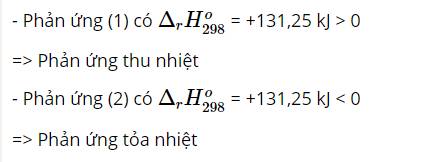


Ta có: ${\Delta _t},H_{298}^o$ > 0 => Đây là phản ứng thu nhiệt
=> Phản ứng sẽ hấp thụ năng lượng dưới dạng nhiệt
=> Nhiệt độ của hỗn hợp giảm