Hãy biểu diễn sự hình thành các cặp electron chung cho phân tử NH3. Từ đó, viết công thức Lewis của phân tử này.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Cấu hình electron của N (Z = 7): 1s22s22p3
- Để đạt cấu hình của khí hiếm gần nhất, mỗi nguyên tử N đều cần thêm 3 electron. Vì vậy mỗi nguyên tử N cùng góp 3 electron để tạo nên 3 cặp electron chung cho 2 nguyên tử N.
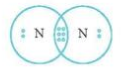
⟹ Số cặp electron dùng chung là 3.
⟹ Công thức Lewis của N2:
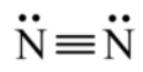

- Phân tử H2O:
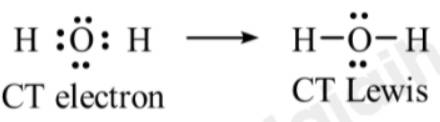
⟹ Phân tử H2O có 2 cặp electron hóa trị riêng.
- Phân tử CH4:
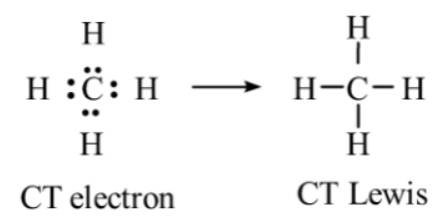
⟹ Phân tử CH4 không có cặp electron hóa trị riêng.

- Trong phân tử phosphorus trichloride gồm 2 nguyên tố: P và Cl
+ Nguyên tử P có 5 electron ở lớp ngoài cùng => Góp chung 3 electron độc thân để hình thành 3 liên kết cộng hóa trị
+ Nguyên tử Cl có 7 electron ở lớp ngoài cùng => 3 nguyên tử Cl, mỗi nguyên tử góp chung 1 electron độc thân để hình thành 3 liên kết cộng hóa trị với P.
=> Khi đó, quanh P và Cl đều có 8 electron như khí hiếm Argon.
- Công thức Lewis của phân tử:


- Từ công thức electron của CO2:
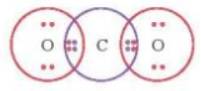
⟹ Mỗi nguyên tử O có 2 cặp electron dùng chung với nguyên tử C.
- Viết công thức Lewis của CO2: O = C = O

Bước 1: Viết cấu hình electron của N (Z = 7) và H (Z = 1)
N (Z = 7): 1s22s22p3
H (Z = 1): 1s1
Bước 2: Biểu diễn sự hình thành các cặp electron chung cho NH3
H có 1e ở lớp electron ngoài cùng, N có 5e ở lớp electron ngoài cùng.
⟹ Mỗi nguyên tử góp chung 1e để đạt cấu hình khí hiếm bền vững.
Bước 3: Công thức Lewis của NH3