Trong phòng thí nghiệm cần điều chế 2.479 lít khí hydrogen người ta dùng kim loại zinc tác dung dịch acid hydrogen chloride nồng độ 2m theo pthh Zn + 2hcl=zncl² + h² Tính khối lượng của kim loại zinc cần dùng để điều chế khí hydrogen nói trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.m_{ZnCl_2}=13,6\left(g\right)\)

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{Zn}=\dfrac{39}{65}=0,6\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Zn}=1,2\left(mol\right)\Rightarrow m_{HCl}=1,2.36,5=43,8\left(g\right)\)
c, \(n_{H_2}=n_{Zn}=0,6\left(mol\right)\Rightarrow V_{H_2}=0,6.24,79=14,874\left(l\right)\)
d, - Quỳ tím hóa đỏ do HCl dư.

\(n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,1<---0,2------>0,1--->0,1
=> mZn = 0,1.65 = 6,5(g)
=> VH2 = 0,1.22,4 = 2,24(l)
=> mZnCl2 = 0,1.136 = 13,6(g)

a, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
_____0,2____0,4___________0,2 (mol)
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
b, \(V_{H_2}=0,2.24,79=4,958\left(l\right)\)
c, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
____________0,2__2/15 (mol)
\(\Rightarrow m_{Fe}=\dfrac{2}{15}.56=\dfrac{112}{15}\left(g\right)\)
Số mol của 13 gam Zn:
\(n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
1 : 2 : 1 : 1 (g)
0,2\(\rightarrow\) 0,4 : 0,2 : 0,2 (mol)
a,Khối lượng của 0,4 mol HCl:
\(m_{HCl}=n.M=0,4.36,5=14,6\left(g\right)\)
b, Thể tích khí H2:
\(V_{H_2}=n.24,79=0,2.24,79=4,958\left(l\right)\)
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
Khối lượng của \(\dfrac{2}{15}\) mol Fe:
\(n_{Fe}=\dfrac{m}{M}=\dfrac{2}{\dfrac{15}{56}}\approx7,5\left(g\right)\)

a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
_____0,2->0,4------->0,2---->0,2
=> mHCl = 0,4.36,5 = 14,6 (g)
c) mZnCl2 = 0,2.136 = 27,2 (g)
d) VH2 = 0,2.24,79 = 4,958(l)

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,1 0,1 0,1 0,1
\(m_{H_2SO_4}=0,1.98=9,8\left(g\right)\)
\(m_{ZnSO_4}=0,1.161=16,1\left(g\right)\)
\(V_{H_2}=0,1.24,79=2,479\left(l\right)\)
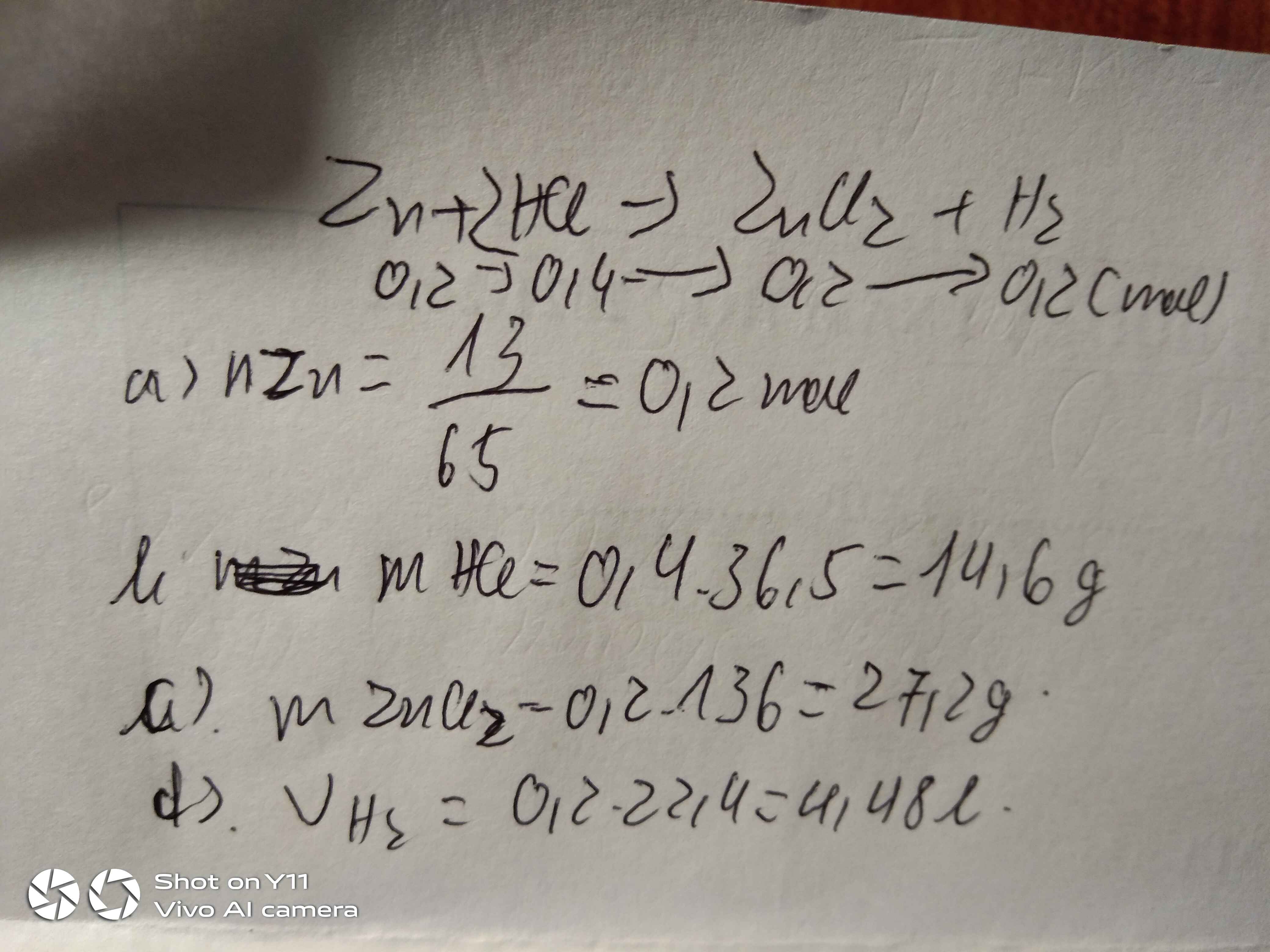
\(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,1 0,2 0,1 0,1
\(m_{Zn}=0,1.65=6,5\left(g\right)\)
Cảm ơn vì đã giải giúp thắc mắc của tôi