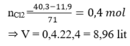Đốt cháy hoàn toàn một sợi dây bằng aluminium (Al) trong bình chứa khí chlorine (Cl2), sau phản ứng thu được 26,7 gam aluminium chloride (AlC/g). Tính thể tích khí chlorine đã tham gia cho phản ứng trên trong điều kiện chuẩn. Al + Cl2 →> AlCI3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Al}=\dfrac{9,45}{27}=0,35\left(mol\right)\\ a,PTHH:2Al+3Cl_2\rightarrow\left(t^o\right)2AlCl_3\\ b,n_{Cl_2}=\dfrac{3}{2}.0,35=0,525\left(mol\right)\\ V_{Cl_2\left(đkc\right)}=0,525.24,79=13,01475\left(l\right)\\ c,n_{AlCl_3}=n_{Al}=0,35\left(mol\right)\\ m_{AlCl_3}=0,35.133,5=46,725\left(g\right)\)

\(n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\)
Pt : \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
0,02-->0,015-->0,01
a) \(m_{Al2O3}=0,01.102=1,02\left(g\right)\)
b) \(V_{O2\left(dktc\right)}=0,015.24,79=0,37185\left(l\right)\)
sửa lại \(V_{\left(dktc\right)}-->V_{\left(dkc\right)}\)

Phương trình hoá học: 4Al + 3O2 → 2Al2O3.
Số mol Al tham gia phản ứng:
n Al = mAl : M Al = 0,54 : 27 = 0,02 mol
a) Từ phương trình hóa học ta có:
n Al2O3 = ½ n Al = 0,02 : 2 = 0,01 mol
n Al2O3 = 0,01 x 102 = 10,2 gam
b) theo phương trình hóa học ta có:
n O2 = ¾ n Al = ¾ x 0,02 = 0,015 mol
V O2 (đkc) = 0,015 x 24,79 = 0,37185 (lít)
\(PTHH:4Al+3O_2\left(t^o\right)\rightarrow2Al_2O_3\\ n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\Rightarrow n_{Al}=\dfrac{2}{4}.0,02=0,01\left(mol\right);n_{O_2}=\dfrac{3}{4}.0,02=0,15\left(mol\right)\\ a,m_{Al_2O_3}=0,01.27=0,27\left(g\right)\\ b,V_{O_2\left(đkc\right)}=0,15.24,79=3,7185\left(l\right)\)

\(4Al+3O_2\underrightarrow{^{to}}2Al_2O_3\\ n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\\ \Rightarrow n_{Al_2O_3}=\dfrac{2}{4}.0,02=0,01\left(mol\right)\\ n_{O_2}=\dfrac{3}{4}.0,02=0,015\left(mol\right)\\ m_{Al_2O_3}=102.0,01=1,02\left(g\right)\\ V_{O_2\left(đktc\right)}=0,015.22,4=0,336\left(l\right)\)

a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Gọi: mO2 = x (g) ⇒ mAl = 1,5x (g)
Theo ĐLBT KL, có: mAl + mO2 = mAl2O3
⇒ 1,5x + x = 10
⇒ x = 4 (g) = mO2
mAl = 1,5.4 = 6 (g)

Bài 1 : Sửa ZnSO thành ZnSO4
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Theo Pt : \(n_{Zn}=n_{H2SO4}=n_{ZnSO4}=n_{H2}=0,2\left(mol\right)\)
a) \(m_{H2SO4}=0,2.98=19,6\left(g\right)\)
b) \(m_{ZnSO4}=0,2.161=32,2\left(g\right)\)
c) \(V_{H2\left(dkc\right)}=0,2.24,79=4,958\left(l\right)\)
Bài 3 :
\(n_{O2}=\dfrac{9,6}{32}=0,3\left(mol\right)\)
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\)
0,2<-----------0,2<----0,3
a) \(m_{KClO3}=0,2.122,5=24,5\left(g\right)\)
b) Cách 1 : \(m_{KCl}=0,2.74,5=14,9\left(g\right)\)
cách 2 : \(BTKl:m_{KClO3}=m_{KCl}+m_{O2}\)
\(\Rightarrow m_{KCl}=m_{KClO3}-m_{O2}=24,5-9,6=14,9\left(g\right)\)

a.
Chất tham gia : alunium , hydrochloric acid
Chất sản phẩm : aluminium chloride , khí hydrogen
b.
alunium + hydrochloric acid → aluminium chloride + khí hydrogen
c.
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
d.
\(m_{H_2}=m_{Al}+m_{HCl}-m_{AlCl_2}=10.5+20-15.5=15\left(g\right)\)