Có 3 lọ không nhãn, mỗi lọ đựng một trong 3 chất rắn màu trắng sau: CaCO3, CaO, P2O5. Hãy nhận chất dựng trọng mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học. 6) Trong xây dựng. khi để lâu trong không khí thì trên bề mặt nước vôi trong (Ca(OH)2) sẽ tạo lớp váng trắng (CaCO3). a) Hãy giải thích tại sao? b) Viết phương trình hóa học xảy ra. c) Lớp vâng sấy khô và cân được 11 gam. Hỏi khối lượng Ca(OH)2 đã tham gia phản ứng là bao nhiêu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dùng H2O, quỳ tím và dd HCl để nhận biết được mỗi chất theo sơ đồ nhận biết sau đây:

Trích một ít dd làm mẫu thử
Nhúm quỳ tím vào 3 mẫu thử :
+ Quỳ hóa xanh : NaOH , Ba(OH)2 (1)
+ Quỳ không đổi màu : NaCl
Cho (1) tác dụng với dd H2SO4
+ Tạo kết tủa trắng : Ba(OH)2
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
Không hiện tượng : NaOH

- Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa xanh: NaOH, Ba(OH)2. (1)
+ Quỳ không đổi màu: NaCl.
- Cho mẫu thử nhóm (1) pư với Na2SO4.
+ Có tủa trắng: Ba(OH)2
PT: \(Ba\left(OH\right)_2+Na_2SO_4\rightarrow BaSO_{4\downarrow}+2NaOH\)
+ Không hiện tượng: NaOH.
- Dán nhãn.

Hòa tan mẫu thử từng chất vào nước để tạo thành các dung dịch tương ứng. Cho quỳ tím vào mỗi dung dịch: Nếu quỳ tím chuyển sang màu xanh là NaOH và Ba(OH)2, nếu quỳ tím không đổi màu là NaCl.
Như vậy đã tìm được Nacl, tiếp tục tìm cách nhận biết: NaOH và Ba(OH)2
Dẫn khí CO2 vào hai dung dịch bazơ còn lại: Nếu có kết tủa xuất hiện là Ba(OH)2 nếu không kết tủa là NaOH.
Ba(OH)2 + CO2 → BaCO3↓ + H2O
2NaOH + CO2 → Na2CO3 + H2O
+Lấy mỗi chất 1 lượng xác định và đánh STT.
+ Cho các chất hòa tan nước rồi cho td với dd CuSO4:
- Nếu xuất hiện kết tủa trắng, xanh : Ba(OH)2
Ba(OH)2 + CuSO4 \(\rightarrow\) BaSO4 \(\downarrow\) + Cu(OH)2 \(\downarrow\)
- Nếu xuất hiện kết tủa xanh : NaOH
NaOH + CuSO4 \(\rightarrow\) Na2SO4 + Cu(OH)2 \(\downarrow\)
- Không hiện tượng : NaCl

lấy mẫu , đánh dấu mẫu
- cho quỳ tím vào từng mẫu nếu thấy quỳ tím (xanh) --> Ca(OH)2
- 2 mẫu còn lại cho vào nước nếu thấy :
+mẫu nào tan (CaO)
+ mẫu nào ko tan (CaCO3)
(tự viết pt)

Ta nhỏ nước
Chất tan , có khí là Ca
Chất ít tan dd vẩn đục CaO
Chất tan hết ko hiện tg là P2O5
CaO+H2O->Ca(OH)2
Ca+2H2O->Ca(OH)2+H2
P2O5+3H2O->2H3PO4
Trích mẫu thử $\\$ Cho nước vào từng lọ mất nhãn $\\$ $+$ Chất tan,có khí bay ra $H_2$ là $Ca$ $\\$ $PTHH : Ca + 2H_2O \to Ca(OH)_2 + H_2$ $\\$ $+$ Chất ít tan,dung dịch đục là $CaO$ $\\$ $PTHH: CaO + 2H_2O \to Ca(OH)_2$ $\\$ $+$ Chất tan, nhưng không có hiện tượng sản phẩm làm cho quỳ tím hóa đỏ là $P_2O_5$ $\\$ $PTHH:P_2O_5+3H_2O\to2H_3PO_4$

- Trích một ít các chất làm mẫu thử:
- Hòa tan các chất vào nước dư:
+ Chất rắn tan: NaCl, Na2SO4 (1)
+ Chất rắn không tan: CaCO3
- Cho các chất ở (1) tác dụng với dd BaCl2
+ Không hiện tượng: NaCl
+ Kết tủa trắng: Na2SO4
\(Na_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2NaCl\)
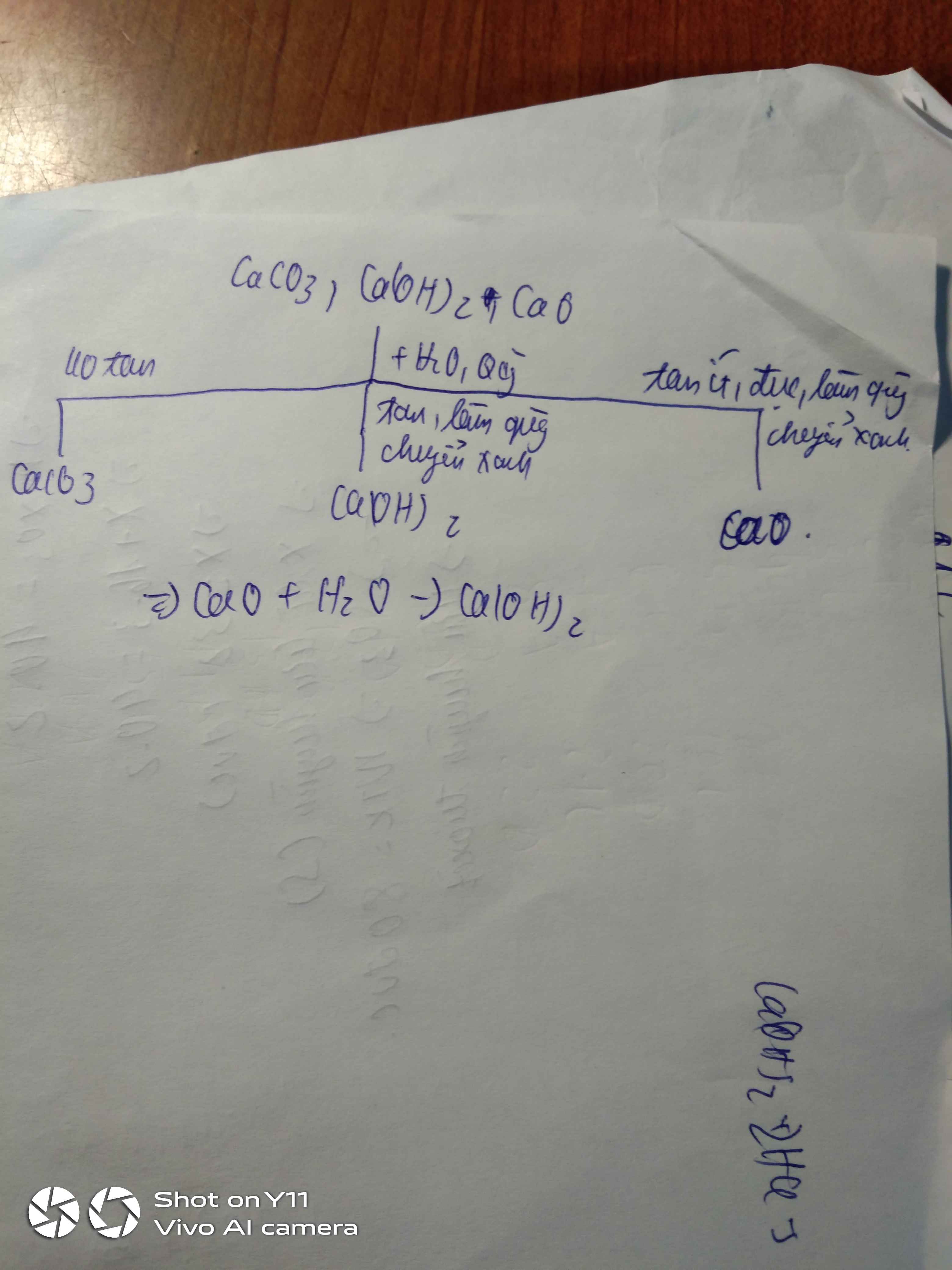

- Trích mẫu thử.
- Hòa tan từng mẫu thử vào nước có quỳ tím.
+ Không tan: CaCO3.
+ Tan, quỳ hóa xanh: CaO.
PT: \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
+ Tan, quỳ hóa đỏ: P2O5.
PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
- Dán nhãn.
6.
a, Xuất hiện váng trắng CaCO3 do Ca(OH)2 pư với CO2 trong không khí.
b, PT: \(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
c, \(n_{CaCO_3}=\dfrac{11}{100}=0,11\left(mol\right)\)
Theo PT: \(n_{Ca\left(OH\right)_2}=n_{CaCO_3}=0,11\left(mol\right)\)
\(\Rightarrow m_{Ca\left(OH\right)_2}=0,11.74=8,14\left(g\right)\)